题目内容
我国化工专家侯德榜先生发明的“侯氏制碱法”的基本原理是;在浓氨水中通入足量的二氧化碳生成一种盐,然后在此盐溶液中加入细的食盐粉末,由于碳酸氢钠在该状态下溶解度很小,呈晶体析出.同时由于大部分酸式碳酸盐不稳定,加热后容易转变为正盐、水和二氧化碳,所以将析出的碳酸氢钠加热分解即可制得纯碱.
根据以上叙述,简要地回答下列问题.
(1)用上述方法进行时,所用的起始原料是哪些物质?写出它们反应的化学方程式.
(2)最终产品是哪些物质?(写出它们的化学式)
(3)该生产过程中没有涉及的基本反应类型是______________________.
(4)有人认为侯氏制碱法的优点有四:①生产过程中部分产品可作为起始原料使用;②副产品是一种可利用的氮肥;③反应不需要(太多加热,可以节约能源;④副产品不会造成环境污染,你认为其中正确的是___________.
解析:
|
(1) 浓氨水、二氧化碳、食盐
(2) 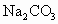 、 、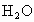 、 、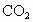
(3) 置换反应(4) ①②③④ |
提示:
|
此题中主要给出三个信息: (1)第二个反应产物是碳酸氢钠;(2)在此状态下碳酸氢钠溶解度很小,可以以晶体形式析出;(3)碳酸氢钠对热不稳定,易分解.该题的解题难点:一是二氧化碳既是原料又是产品;二是根据第二个反应产物是碳酸氢钠,推断第一个反应的产物是碳酸氢铵;三是碳酸氢铵与食盐可以发生复分解反应.如何利用信息处理问题?难点①答题时只要前后联想则不易造成失误;难点②利用已有知识复分解反应的概念,其实质是互换成分,依信息则可推出反应物之一是碳酸氢铵;难点③学生一般认为钠盐易溶于水,难、将碳酸氢钠可以晶体析出联系在一起.因此需要学生对已有知识“溶解度的大小”有深刻的理解,然后用模仿即可完成此题. |

我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为:
NH3+CO2+H2O NH4HCO3
; NH4HCO3+NaCl NaHCO3↓+NH4Cl
;
2NaHCO3 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 (填字母标号);
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
① 一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如右图所示(图中夹持、固定用的仪器未画出)。
试回答下列有关问题:
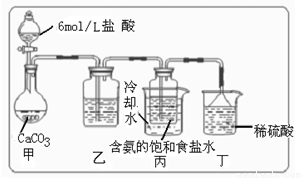
|
(Ⅱ)丁装置中稀硫酸的作用是
(Ⅲ)实验结束后,分离出NaHCO3 晶体的操作是 (填分离操作的名称)。
(IV)请你再写出一种实验室制取少量碳酸氢钠的方法: 。
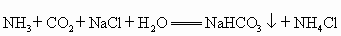
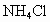


 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
