题目内容
(16分)1942年,我国化工专家侯德榜以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱,他的“侯氏制碱法”为世界制碱工业做出了突出贡献。有关反应的化学方程式如下:
NH3+CO2+H2O NH4HCO3; NH4HCO3+NaCl NaHCO3↓+NH4Cl ;
2NaHCO3 Na2CO3+CO2↑+H2O
(1)“侯氏制碱法”把合成氨和纯碱两种产品联合生产,请写出工业合成氨的化学反应方程式 ;已知合成氨为放热反应,若从勒夏特列原理来分析,合成氨应选择的温度和压强是 (选填字母)。
a.高温 b.低温 c.常温 d.高压 e.低压 f.常压
(2)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 (选填字母)。
a.碳酸氢钠难溶于水 b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(3)某探究活动小组根据上述制碱原理,欲制备碳酸氢钠,同学们按各自设计的方案进行实验。
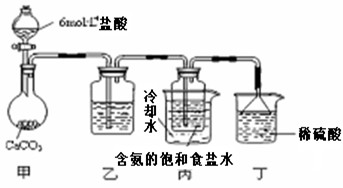
第一位同学:将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示
(图中夹持、固定用的仪器未画出)。
请回答:
①写出甲中发生反应的离子方程式 。
②乙装置中的试剂是 。
③实验结束后,分离出NaHCO3晶体的操作是 (填分离操作的名称)。
第二位同学:用图中戊装置进行实验(其它装置未画出)。
①为提高二氧化碳在此反应溶液中被吸收的程度,实验时,须先从a管通入 气体,再从b管中通入 气体。
②装置c中的试剂为 (选填字母)。
e.碱石灰 f.浓硫酸 g.无水氯化钙
(4)请你再写出一种实验室制取少量碳酸氢钠的方法(用简要的文字和相关的化学反应方程式来描述):
(16分)
(1)(2分)b、d (2分)(2)c(1分)
(3)第一位同学:① CaCO3+ 2H+ = Ca2+ + H2O + CO2↑(2分)
② 饱和碳酸氢钠溶液(2分) ③ 过滤 (1分)
第二位同学:①NH3(氨) CO2 (二氧化碳) ② g(3分)
(4)向烧碱溶液中通入过量CO2:NaOH + CO2 NaHCO3;或向饱和Na2CO3
溶液中通入过量CO2 : Na2CO3+CO2+H2O 2NaHCO3 等,其它合理方法均可。(叙述1分方程式2分)
解析:

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案1942年,我国化工专家侯德榜以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产了纯碱,“侯氏制碱法”为世界制碱工业做出了突出贡献。有关反应的化学方程式如下:
NH3+CO2+H2O=NH4HCO3;NH4HCO3+NaCl=NaHCO3↓+NH4Cl;
2NaHCO3=Na2CO3+CO2↑+H2O
(1)“侯氏制碱法”把合成氨和纯碱两种产品联合生产,已知合成氨为放热反应,若从勒夏特旬原理来分析,合成氨应选择的温度和压强是 (选填字母)。
a.高温 b.低温 c.常温 d.高压 e.低压 f.常压
(2)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 (选填字母)
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(3)某探究活动小组根据 上述制碱原理,欲制备碳酸氢钠,同学们按各自设计的方案进行实验。
第一位同学:将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。
|
第二同学:用图中戊装置进行实验(其它装置未画出)。
为提高二氧化碳在此反应溶液中被吸收的程度,实验时,须先从a管通入 气体,再从b管中通入 气体。
(4)请你再写出一种实验室制取少量碳酸氢钠的方法(用相关的化学反应方程式来描述): 。
 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O