题目内容
已知氧化性:Au3+>Ag+>Cu2+>Pb2+>Cr3+>Zn2+>Ti2+。现有如图所示的电化学装置,下列叙述中正确的是
| A.若X为Ti,则Y极的电极反应式可能是Zn-2e-=Zn2+ |
| B.若X为Cr,则Y可以选Zn或Ti |
| C.若Y为Cu,则X极的电极反应式可能是Cr-3e-=Cr3+ |
| D.若Y为Pb,则Xn+(aq)中阴离子数会减少 |
C
解析试题分析:根据装置图可知,X电极是负极,失去电子发生氧化反应。Y电极是正极,正极得到电子,发生还原反应,据此可以判断。A、若X为Ti,由于Y电极是正极,得到电子发生还原反应,因此A不正确;B、若X为Cr,则Y电极的金属性要弱于Ti的金属性,Zn或Ti的金属性强于Cr的金属性。则Y不能选Zn或Ti,可以选择铜或Pb等,B不正确;C、若Y为Cu,由于X是负极,则X电极的金属性要强于Cu,所以可以选择Cr,因此负极电极反应式可能是Cr-3e-=Cr3+,C正确;D、若Y为Pb,由于X电极是负极,失去电子,发生氧化反应,因此Xn+(aq)中阴离子数会增加,D不正确,答案选C。
考点:考查原电池原理的有关判断和应用

 名校课堂系列答案
名校课堂系列答案全钒液流电池是一种新型的绿色环保储能电池,该电池性能优良,其电池总反应为:V3++VO2++H2O VO2++2H++V2+。下列叙述正确的是 ( )
VO2++2H++V2+。下列叙述正确的是 ( )
| A.充电时阳极附近溶液的酸性减弱 |
| B.充电时阳极反应式为:VO2++2H++e-=VO2++H2O |
| C.放电过程中电解质溶液中阳离子移向负极 |
| D.放电时每转移1mol电子,负极有1mol V2+被氧化 |
实验发现,在FeCl3酸性溶液中加入少量锌粉后,Fe3+立即被还原成Fe2+。某化学兴趣小组根据该实验事实设计了如图所示的原电池装置。下列有关说法中正确的是( )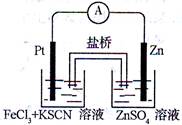
| A.该原电池的正极反应是:Zn-2e— =Zn2+ |
| B.Pt电极表面生成大量气泡 |
| C.左烧杯中溶液的红色逐渐褪去 |
| D.生成的Fe2+通过盐桥可以和锌直接反应生成Fe |
用惰性电极实现电解,下列说法中正确的是 ( )
| A.电解稀硫酸溶液,实质上是电解水,故溶液pH不变 |
| B.电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小 |
| C.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1∶2 |
| D.电解氯化铜溶液,阴极和阳极产物的物质的量之比为1∶1 |
下图所示的电解池I和II中,a、b、c和d均为Pt电极。电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b﹤d。符合上述实验结果的盐溶液是( )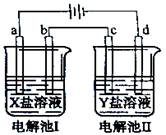
| 选项 | X | Y |
| A. | MgSO4 | CuSO4 |
| B. | AgNO3 | Pb(NO3)2 |
| C. | FeSO4 | Al2 (SO4)3 |
| D. | CuSO4 | AgNO3 |
电解法精炼含有Fe、Zn、Ag等杂质的粗铜。下列叙述正确的是
| A.电解时以硫酸铜溶液作电解液,精铜作阳极 |
| B.粗铜与电源负极相连,发生氧化反应 |
| C.阴极上发生的反应是Cu2++2e-=Cu |
| D.电解后Fe、Zn、Ag等杂质会沉积在电解槽底部形成阳极泥 |
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为: Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是( )
| A.电池工作时,锌失去电子 |
| B.电池正极的电极反应式为:2MnO2+H2O+2e—→Mn2O3+2OH— |
| C.外电路中每通过O.2mol电子,锌的质量理论上减小6.5g[ |
| D.电池工作时,电子由负极通过电解液流向正极 |
下面各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是( )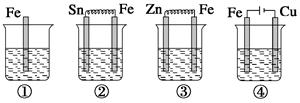
| A.②>①>③>④ | B.④>②>①>③ |
| C.④>②>③>① | D.③>②>④>① |
 从右向左移动。下列分析正确的是
从右向左移动。下列分析正确的是
