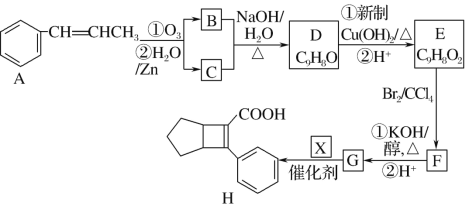
题目内容
【题目】直接排放含SO2的烟气会危害环境。利用工业废碱渣(主要成分Na2CO3)可吸收烟气中的SO2并制备无水Na2SO3,其流程如图1。
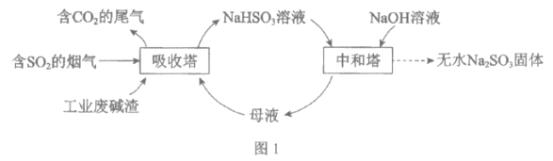
已知:H2SO3、HSO3-、SO32-在水溶液中的物质的量分数随pH的分布如图2, Na2SO3·7H2O和Na2SO3的溶解度曲线如图3。
(1)Na2CO3溶液显碱性,用离子方程式解释其原因:______________。
(2)吸收烟气
①为提高NaHSO3的产率,应控制吸收塔中的pH为______________。
②NaHSO3溶液中c(SO32-)>c(H2SO3),结合方程式解释其原因:____________。
③已知下列反应:
SO2(g)+2OH-(aq)=SO32-(aq)+H2O(l) ![]()
CO2(g)+2OH-(aq)=CO32-(aq)+H2O(l) ![]()
2HSO3-(aq)=SO32-(aq)+SO2(g)+H2O(l) ![]()
吸收塔中Na2CO3溶液吸收SO2生成HSO3-的热化学方程式是______________。
④吸收塔中的温度不宣过高,可能的原因是______________(写出1种即可)。
(3)制备无水Na2SO3:将中和塔中得到的Na2SO3溶液______________(填操作),过滤出的固体用无水乙醇洗涤、干燥,得无水Na2SO3固体。
【答案】CO32-+H2O![]() OH-+HCO3- 4~5 溶液中,HSO3-存在:HSO3-
OH-+HCO3- 4~5 溶液中,HSO3-存在:HSO3-![]() H++SO32-和HSO3-+H2C
H++SO32-和HSO3-+H2C![]() H2SO3+OH-,HSO3-的电离程度强于水解程度 2SO2(g)+CO32-(aq)+H2O(1)=2HSO3-(aq)+CO2(g)
H2SO3+OH-,HSO3-的电离程度强于水解程度 2SO2(g)+CO32-(aq)+H2O(1)=2HSO3-(aq)+CO2(g) ![]() 防止SO2的溶解度下降;防止HSO3-受热分解;防止HSO3-的氧化速率加快等 隔绝空气,加热浓缩至有大量固体析出,高于34℃过滤
防止SO2的溶解度下降;防止HSO3-受热分解;防止HSO3-的氧化速率加快等 隔绝空气,加热浓缩至有大量固体析出,高于34℃过滤
【解析】
(1)Na2CO3为强碱弱酸盐,水解呈碱性;
(2)①由图象可知pH在4~5时NaHSO3的物质的量分数最高;
②NaHSO3溶液中c(SO32-)>c(H2SO3),说明HSO3-电离程度大于水解程度;
③已知:①SO2(g)+2OH- (aq)═SO32- (aq)+H2O(l)△H1=-164.3kJmol-1,②CO2(g)+2OH- (aq)═CO32- (aq)+H2O(l)△H2=-109.4kJmol-1,③2HSO3- (aq)═SO32- (aq)+SO2(g)+H2O(l)△H3=+34.0kJmol-1,利用盖斯定律将①-②-③可得Na2CO3溶液吸收SO2生成HSO3-的热化学方程式;
④HSO3-不稳定,易分解,如温度过高,可导致气体的溶解度下降,且HSO3-易被氧化;
(3)得无水Na2SO3固体,温度应高于34℃,且防止被氧化。
(1)Na2CO3为强碱弱酸盐,水解呈碱性,离子方程式为CO32-+H2O![]() OH-+HCO3-;
OH-+HCO3-;
(2)①由图象可知pH在4~5时NaHSO3的物质的量分数最高;
②NaHSO3溶液中存在HSO3-![]() H++SO32-和HSO3-+H2O
H++SO32-和HSO3-+H2O![]() H2SO3+OH-,c(SO32-)>c(H2SO3),说明HSO3-电离程度大于水解程度;
H2SO3+OH-,c(SO32-)>c(H2SO3),说明HSO3-电离程度大于水解程度;
③已知:①SO2(g)+2OH- (aq)═SO32- (aq)+H2O(l)△H1=-164.3kJmol-1,②CO2(g)+2OH- (aq)═CO32- (aq)+H2O(l)△H2=-109.4kJmol-1,③2HSO3- (aq)═SO32- (aq)+SO2(g)+H2O(l)△H3=+34.0kJmol-1,利用盖斯定律将①-②-③可得Na2CO3溶液吸收SO2生成HSO3-的热化学方程式为2SO2(g)+CO32-(aq)+H2O(l)═2HSO3-(aq)+CO2 (g)△H=-88.9 kJmol-1;
④HSO3-不稳定,易分解,如温度过高,可导致气体的溶解度下降,且HSO3-易被氧化,则吸收塔的温度不易过高;
(3)得无水Na2SO3固体,温度应高于34℃,且防止被氧化,可隔绝空气,加热浓缩至有大量固体析出。

【题目】某小组以4H++4I-+O2=2I2+2H2O为研究对象,探究影响氧化还原反应因素。
实验 | 气体a | 编号及现象 |
| HCl | Ⅰ.溶液迅速呈黄色 |
SO2 | Ⅱ.溶液较快呈亮黄色 | |
CO2 | Ⅲ.长时间后,溶液呈很浅的黄色 | |
空气 | Ⅳ.长时间后,溶液无明显变化 |
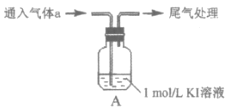
(1)实验Ⅳ的作用是______________。用CCl4萃取Ⅰ、Ⅱ、Ⅲ、Ⅳ的溶液,萃取后下层CCl4的颜色均无明显变化。
(2)取萃取后上层溶液,用淀粉检验:Ⅰ、Ⅲ的溶液变蓝;Ⅱ、Ⅳ的溶液未变蓝。溶液变蓝说明Ⅰ、Ⅲ中生成了______________。
(3)查阅资料:I2易溶于KI溶液。下列实验证实了该结论并解释Ⅰ、Ⅲ的萃取现象。
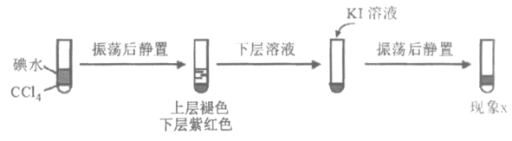
现象x是______________。
(4)针对Ⅱ中溶液未检出I2的原因,提出三种假设:
假设1:溶液中c(H+)较小。小组同学认为此假设不成立,依据是______________。
假设2:O2只氧化了SO2,化学方程式是______________。
假设3:I2不能在此溶液中存在。
(5)设计下列实验,验证了假设3,并继续探究影响氧化还原反应的因素。
i.取Ⅱ中亮黄色溶液,滴入品红,红色褪去。
ii.取Ⅱ中亮黄色溶液,加热,黄色褪去,经品红检验无SO2。加入酸化的AgNO3溶液,产生大量AgI沉淀,长时间静置,沉淀无明显变化。
iii.取Ⅱ中亮黄色溶液,控制一定电压和时间进行电解,结果如下。
电解时间/min | 溶液 | 阳极 | 阴极 |
t1 | 黄色变浅、有少量SO42- | 检出I2,振荡后消失 | H2 |
| 溶液无色、有大量SO42- | 检出I2,振荡后消失 | H2 |
结合化学反应,解释上表中的现象:______________。
(6)综合实验证据说明影响I-被氧化的因素及对应关系______________。