��Ŀ����
����Ŀ����֪��pKa����lgKa��25��ʱ��H2A��pKal��1.85��pKa2��7.19�������£���0.1 mol��L-1NaOH��Һ�ζ�20 mL 0.1 mol��L-1H2A��Һ�ĵζ�������ͼ��ʾ������˵����ȷ����

A. a��������Һ�У�V0��10 mL
B. b��������Һ�У�c(H2A)+c(H+)��c(HA��)+c(OH��)
C. A2��ˮ��ƽ�ⳣ��Kh(A2��)��10��7.19
D. c��������Һ�У�c(A2��)��c(HA��)
���𰸡�D
��������A������ͼ���֪��a��pH=1.85=pKal����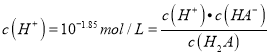 ������a��c(H2A)=c(HA-)������A������a������NaOHΪ10mL����a����Һ������ΪH2A��NaHA�������ʵ���֮��Ϊ1��1������Ҫ���ǵ����ˮ�⣬��pKal��1.85��pKa2��7.19��֪��H2A��NaHA��1��1���ʱ��H2Aռ��Ҫ��λ�����Դ�ʱ��Һ��c(H2A)��c(HA-)�����費������ʵ����a��NaOHӦ��С��10mL����A���� B��b������0.1molL-1NaOH��Һ�ζ�20mL0.1molL-1H2A��Һ��ǡ�÷�Ӧ����NaHA���������غ�ɵ�c(H2A)+c(H+)=c(A2-)+c(OH-)����B���� C��A2-ˮ��ƽ�ⳣ��Khl=Kw/Ka2=10-6.81����C����D��c��pH=7.19=pKa2��
������a��c(H2A)=c(HA-)������A������a������NaOHΪ10mL����a����Һ������ΪH2A��NaHA�������ʵ���֮��Ϊ1��1������Ҫ���ǵ����ˮ�⣬��pKal��1.85��pKa2��7.19��֪��H2A��NaHA��1��1���ʱ��H2Aռ��Ҫ��λ�����Դ�ʱ��Һ��c(H2A)��c(HA-)�����費������ʵ����a��NaOHӦ��С��10mL����A���� B��b������0.1molL-1NaOH��Һ�ζ�20mL0.1molL-1H2A��Һ��ǡ�÷�Ӧ����NaHA���������غ�ɵ�c(H2A)+c(H+)=c(A2-)+c(OH-)����B���� C��A2-ˮ��ƽ�ⳣ��Khl=Kw/Ka2=10-6.81����C����D��c��pH=7.19=pKa2�� 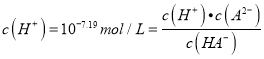 ������c(A2-)=c(HA-)����D��ȷ��ѡD��
������c(A2-)=c(HA-)����D��ȷ��ѡD��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�







