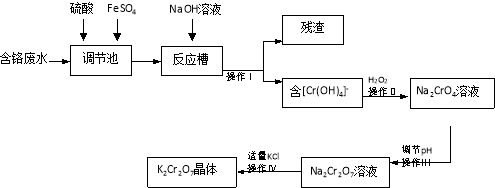
题目内容
【题目】碳、硫和氮元素及其化合物的处理,是资源利用和环境保护的重要研究课题。
(1)CO可转化成二甲醚,原理为:2CO(g)+4H2(g) ![]() CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
已知一定条件下,该反应中CO的平衡转化率随温度、投料比[n(H2)/n(CO)]的变化曲线


若温度升高,则反应的平衡常数K将 (填“增大”、“减小”或“不变”);
(2)SO2的水溶液呈酸性,某温度下,0.02mol·L-1亚硫酸水溶液的pH等于2,若忽略亚硫酸的二级电离和H2O的电离,则该温度下亚硫酸的一级电离常数Ka1= 。
(3)已知:反应1:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH1;
2SO3(g) ΔH1;
反应2:2NO(g)+O2(g) ![]() 2NO2(g) ΔH2;
2NO2(g) ΔH2;
若ΔH1<ΔH2<0,则反应3:SO2(g)+NO2(g) ![]() SO3(g)+NO(g)属于 (填“放热”或“吸热”)反应。
SO3(g)+NO(g)属于 (填“放热”或“吸热”)反应。
(4)若用少量NaOH溶液吸收SO2气体,对产物NaHSO3进一步电解可制得硫酸,电解原理示意图(见右图)。电解时阳极的电极反应式为 。
(5)在恒温密闭容器中通入SO2和NO2各1mol发生反应3:SO2(g)+NO2(g) ![]() SO3(g)+NO(g),当反应达到平衡后,维持温度和容积不变,10min时再通入各1mol的SO2和NO2的混合气体,20min时再次平衡。两次平衡时NO2的转化率α1 α2(填“>”、“<”、“=”);请在上图中画出正反应速率v正在10至30min间随时间变化的曲线图。
SO3(g)+NO(g),当反应达到平衡后,维持温度和容积不变,10min时再通入各1mol的SO2和NO2的混合气体,20min时再次平衡。两次平衡时NO2的转化率α1 α2(填“>”、“<”、“=”);请在上图中画出正反应速率v正在10至30min间随时间变化的曲线图。

【答案】(1)减小;(2)Ka1=1.0×10-2;(3)放热;
(4)HSO3--2e-+H2O=SO42-+3H+;
(5)=, 。
。
【解析】
试题分析:(1)随着温度的升高,CO的转化率降低,根据勒夏特列原理,升高温度,平衡向吸热反应方向移动,即向逆反应方向移动,则化学平衡常数减小; (2)亚硫酸属于二元弱酸,忽略二级电离,H2SO3![]() H++HSO3-,根据电离平衡常数的定义,Ka1=c(H+)×c(HSO3-)/c(H2SO3)=10-2×10-2/(0.02-10-2)= 1.0×10-2;(3)(反应1-反应2)/2得出反应③,△H=(△H1-△H2)/2,因为△H1<△H2<0,(△H1-△H2)/2<0,因此反应3是放热反应;(4)跟电源的正极相连的电极为阳极,即右端为阳极,阳极失电子化合价升高,因此电极反应式为:HSO3-+H2O-2e-=SO42-+3H+;(5)反应前后气体系数之和相等,两个平衡为等效平衡,即转化率相等,但增大反应物浓度,正反应速率增大,平衡向正反应方向移动,因此图像为:
H++HSO3-,根据电离平衡常数的定义,Ka1=c(H+)×c(HSO3-)/c(H2SO3)=10-2×10-2/(0.02-10-2)= 1.0×10-2;(3)(反应1-反应2)/2得出反应③,△H=(△H1-△H2)/2,因为△H1<△H2<0,(△H1-△H2)/2<0,因此反应3是放热反应;(4)跟电源的正极相连的电极为阳极,即右端为阳极,阳极失电子化合价升高,因此电极反应式为:HSO3-+H2O-2e-=SO42-+3H+;(5)反应前后气体系数之和相等,两个平衡为等效平衡,即转化率相等,但增大反应物浓度,正反应速率增大,平衡向正反应方向移动,因此图像为: 。
。

 同步练习强化拓展系列答案
同步练习强化拓展系列答案