题目内容
请设计实验:用MnO2与浓盐酸制备纯净、干燥的Cl2,其他药品与试剂任选.(1)写出该反应的化学方程式
(2)在下面方框中,A表示有分液漏斗和圆底烧瓶组成的气体发生器,请在虚线框内的A后完成该反应的实验装置示意图(夹持装置、连接胶管不必画出,需要加热的仪器下方用△标出),按气流方向在每件仪器下方标出字母B、C…;其他可选用的仪器(数量不限)简易表示如下:
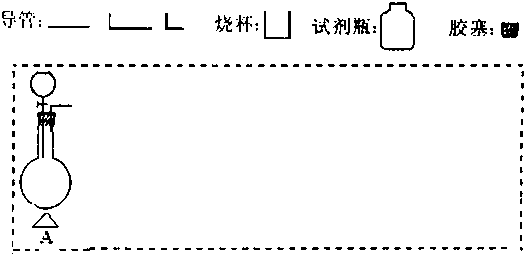
(3)根据方框中的装置图,完成下表(若无需填写,则在表格中写“无”)
| 仪器符号 | 仪器中所加物质 | 作用 |
| A | MnO2、浓盐酸 | MnO2与浓盐酸生成Cl2 |
(5)请写出Cl2在工业、农业、医疗、卫生等方面的用途
(6)将Cl2与SO4分别通入品红溶液,都能使品红褪色.简述用褪色的溶液区别二者的实验方法.
分析:(1)实验室制备氯气是利用二氧化锰和浓盐酸加热反应生成氯化锰、氯气和水;
(2)用MnO2与浓盐酸制备纯净、干燥的Cl2,需要在装置A中加入二氧化锰固体,分液漏斗中加入浓盐酸,加热反应生成氯气,氯气中含有水蒸气和氯化氢气体,需要先通过饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气,在集气瓶中收集纯净干燥的氯气,最后用氢氧化钠溶液吸收氯气防止污染空气;
(3)依据(2)分析步骤选择所需试剂和所起的主要作用;
(4)依据高锰酸钾溶液能氧化浓盐酸生成氯气,依据电荷守恒和原子守恒配平离子方程式;
(5)依据氯气的性质和应用分析判断用途;
(6)依据二氧化硫的漂白作用是和品红形成不稳定化合物,加热会恢复颜色,氯气和水反应生成的次氯酸具有漂白作用是利用氧化性氧化品红试液,加热不能恢复颜色;
(2)用MnO2与浓盐酸制备纯净、干燥的Cl2,需要在装置A中加入二氧化锰固体,分液漏斗中加入浓盐酸,加热反应生成氯气,氯气中含有水蒸气和氯化氢气体,需要先通过饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气,在集气瓶中收集纯净干燥的氯气,最后用氢氧化钠溶液吸收氯气防止污染空气;
(3)依据(2)分析步骤选择所需试剂和所起的主要作用;
(4)依据高锰酸钾溶液能氧化浓盐酸生成氯气,依据电荷守恒和原子守恒配平离子方程式;
(5)依据氯气的性质和应用分析判断用途;
(6)依据二氧化硫的漂白作用是和品红形成不稳定化合物,加热会恢复颜色,氯气和水反应生成的次氯酸具有漂白作用是利用氧化性氧化品红试液,加热不能恢复颜色;
解答:解:(1)实验室制备氯气是利用二氧化锰和浓盐酸加热反应生成氯化锰、氯气和水,反应的化学方程式为:MnO2+4HCl(浓)
MnCl2+C12↑+2H2O;
故答案为:MnO2+4HCl(浓)
MnCl2+C12↑+2H2O;
(2)用MnO2与浓盐酸制备纯净、干燥的Cl2,需要在装置A中加入二氧化锰固体,分液漏斗中加入浓盐酸,加热反应生成氯气,氯气中含有水蒸气和氯化氢气体,需要先通过饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气,在集气瓶中收集纯净干燥的氯气,最后用氢氧化钠溶液吸收氯气防止污染空气;装置图设计为: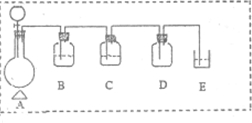
故答案为: ;
;
(3)依据(2)设计步骤和试剂选择用MnO2与浓盐酸制备纯净、干燥的Cl2,需要在装置A中加入二氧化锰固体,分液漏斗中加入浓盐酸,加热反应生成氯气,氯气中含有水蒸气和氯化氢气体,需要先通过饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气,在集气瓶中收集纯净干燥的氯气,最后用氢氧化钠溶液吸收氯气防止污染空气;
故答案为:
(4)KMnO4与浓盐酸在常温下反应也可以得到Cl2,写出该反应的离子方程式为:2MnO4+16H++10Cl-
2Mn2++5Cl2↑+8H2O;
故答案为:2MnO4+16H++10Cl-
2Mn2++5Cl2↑+8H2O;
(5)Cl2在工业、农业、医疗、卫生等方面的用途有自来水消毒、制农药、塑料等;
故答案为:自来水消毒、制农药、塑料等;
(6)将Cl2与SO2分别通入品红溶液,都能使品红褪色,用褪色的溶液区别二者的实验方法是利用二氧化硫的漂白作用是生成不稳定化合物,加热会恢复品红颜色,氯气通入次氯酸的氧化性把品红氧化为无色物质,加热不恢复红色,设计的步骤为:取适量的已褪色的品红溶液于试管中,用酒精灯加热.若品红溶液颜色复原为红色,则为SO2使其褪色;若品红溶液颜色仍为无色,则为C12使其褪色;
故答案为:取适量的已褪色的品红溶液于试管中,用酒精灯加热.若品红溶液颜色复原为红色,则为SO2使其褪色;若品红溶液颜色仍为无色,则为C12使其褪色;
| ||
故答案为:MnO2+4HCl(浓)
| ||
(2)用MnO2与浓盐酸制备纯净、干燥的Cl2,需要在装置A中加入二氧化锰固体,分液漏斗中加入浓盐酸,加热反应生成氯气,氯气中含有水蒸气和氯化氢气体,需要先通过饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气,在集气瓶中收集纯净干燥的氯气,最后用氢氧化钠溶液吸收氯气防止污染空气;装置图设计为:

故答案为:
 ;
;(3)依据(2)设计步骤和试剂选择用MnO2与浓盐酸制备纯净、干燥的Cl2,需要在装置A中加入二氧化锰固体,分液漏斗中加入浓盐酸,加热反应生成氯气,氯气中含有水蒸气和氯化氢气体,需要先通过饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气,在集气瓶中收集纯净干燥的氯气,最后用氢氧化钠溶液吸收氯气防止污染空气;
| 仪器符号 | 仪器中所加物质 | 作用 |
| B | 饱和食盐水 | 除去Cl2中的HCl |
| C | 浓硫酸 | 除去Cl2中的H2O |
| D | 无 | 收集氯气 |
| E | NaOH溶液 | 尾气处理,防止环境污染 |
| 仪器符号 | 仪器中所加物质 | 作用 |
| B | 饱和食盐水 | 除去Cl2中的HCl |
| C | 浓硫酸 | 除去Cl2中的H2O |
| D | 无 | 收集氯气 |
| E | NaOH溶液 | 尾气处理,防止环境污染 |
| ||
故答案为:2MnO4+16H++10Cl-
| ||
(5)Cl2在工业、农业、医疗、卫生等方面的用途有自来水消毒、制农药、塑料等;
故答案为:自来水消毒、制农药、塑料等;
(6)将Cl2与SO2分别通入品红溶液,都能使品红褪色,用褪色的溶液区别二者的实验方法是利用二氧化硫的漂白作用是生成不稳定化合物,加热会恢复品红颜色,氯气通入次氯酸的氧化性把品红氧化为无色物质,加热不恢复红色,设计的步骤为:取适量的已褪色的品红溶液于试管中,用酒精灯加热.若品红溶液颜色复原为红色,则为SO2使其褪色;若品红溶液颜色仍为无色,则为C12使其褪色;
故答案为:取适量的已褪色的品红溶液于试管中,用酒精灯加热.若品红溶液颜色复原为红色,则为SO2使其褪色;若品红溶液颜色仍为无色,则为C12使其褪色;
点评:本题考查了氯气的制备实验方法和除杂方法,收集方法和试剂选择,物质性质的理解应用,掌握物质性质和实验设计方法是解题关键,题目难度中等.

练习册系列答案
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案
相关题目