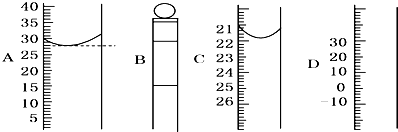
题目内容
如图所示,锥形瓶中加入亚硫酸钠固体和1∶1的硫酸,玻璃管内装入分别滴有不同溶液的棉球,反应一段时间后,对图中指定部位颜色描述正确的是________


答案:C
解析:
解析:
|
本题考查的是二氧化硫的性质.在锥形瓶中会生成二氧化硫,由于它是一种酸性气体,所以在遇到石蕊试液时,石蕊试液变红;二氧化硫能与品红生成无色的不稳定物质,所以品红褪色;由于二氧化硫具有较强的还原性,所以能使酸性高锰酸钾溶液褪色. |

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 现使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).
现使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).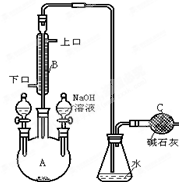 制备溴苯的实验装置如图所示,回答下列问题:
制备溴苯的实验装置如图所示,回答下列问题: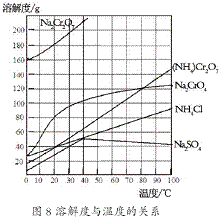 (2012?江苏一模)重铬酸铵[(NH4)2Cr2O7]是一种桔黄色结晶,可用作有机合成催化剂、实验室制纯净的N2及Cr2O3等.实验室可由工业级铬酸钠(Na2CrO4)为原料制取.有关物质溶解度如图所示.实验步骤如下:
(2012?江苏一模)重铬酸铵[(NH4)2Cr2O7]是一种桔黄色结晶,可用作有机合成催化剂、实验室制纯净的N2及Cr2O3等.实验室可由工业级铬酸钠(Na2CrO4)为原料制取.有关物质溶解度如图所示.实验步骤如下: