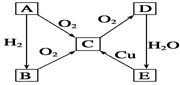
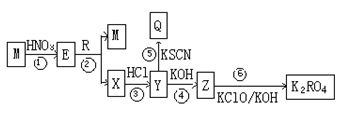
题目内容
X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,已知:
①X元素原子价电子排布式为ns2np2,且原子半径是同族元素中最小的。
②Y元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电
子排布中,p轨道上只有1个未成对电子。
③Z+与Y 2-具有相同的电子层结构;
请回答:
(1)Z2Y2的电子式为 ,含有的化学键类型为 ,Z2Y2为 晶体。
(2)X、Y、Z三种元素所形成的常见化合物的名称为 ;XY2的结构式为 ,分子的立体构型为 。
(3)X、Y、Z、W四种元素所形成的单质中,熔点最高、硬度最大的是 (填名称);晶体ZW的熔点比晶体XW4明显高的原因是 。
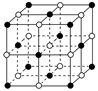
(4)ZW晶体的结构示意图如图。已知:ZW晶体的密度为ρ,摩尔质量为M,阿伏伽德罗常数为NA,则ZW晶体中两个最近的Z离子中心间的距离d可以表示为d= 。
①X元素原子价电子排布式为ns2np2,且原子半径是同族元素中最小的。
②Y元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电
子排布中,p轨道上只有1个未成对电子。
③Z+与Y 2-具有相同的电子层结构;
请回答:
(1)Z2Y2的电子式为 ,含有的化学键类型为 ,Z2Y2为 晶体。
(2)X、Y、Z三种元素所形成的常见化合物的名称为 ;XY2的结构式为 ,分子的立体构型为 。
(3)X、Y、Z、W四种元素所形成的单质中,熔点最高、硬度最大的是 (填名称);晶体ZW的熔点比晶体XW4明显高的原因是 。

(4)ZW晶体的结构示意图如图。已知:ZW晶体的密度为ρ,摩尔质量为M,阿伏伽德罗常数为NA,则ZW晶体中两个最近的Z离子中心间的距离d可以表示为d= 。
(每空2分). (1) 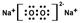 离子键、非极性共价键, 离子
离子键、非极性共价键, 离子
(2) 碳酸钠,,直线形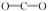
(3) 金刚石; NaCl为离子晶体而CCl4为分子晶体 (4)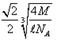
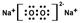 离子键、非极性共价键, 离子
离子键、非极性共价键, 离子 (2) 碳酸钠,,直线形
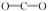
(3) 金刚石; NaCl为离子晶体而CCl4为分子晶体 (4)
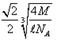
试题分析:X元素原子价电子排布式为ns2np2,且原子半径是同族元素中最小的,所以X应该是第ⅣA族元素的碳元素。Y元素是地壳中含量最多的元素,因此Y是氧元素。W元素的电负性略小于Y元素,在W原子的电子排布中,p轨道上只有1个未成对电子,且W的原子序数大于氧元素的,所以W是氯元素。Z+与Y 2-具有相同的电子层结构,则Z是钠元素。在氯化钠晶胞中含有4个钠离子和4个氯离子,设晶胞的边长是x,则
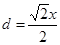 。又因为
。又因为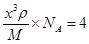 ,解得d=
,解得d=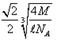 。
。点评:该题是高考中的常见考点,属于基础性试题的考查。试题综合性强,难易适中,侧重对学生基础知识的巩固和训练,有利于培养学生的逻辑推理能力和抽象思维能力,提高学生灵活运用基础知识解决实际问题的能力。本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力,考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目