题目内容
19.往澄清石灰水中通入二氧化碳反应的离子方程式:Ca2++2 OH-+CO2=CaCO3↓+H2O或者CO2+OH-=HCO3-..分析 少量二氧化碳能使石灰水中的氢氧化钙反应生成碳酸钙白色沉淀和水;
过量的CO2和澄清石灰水反应生成碳酸氢钙.
解答 解:少量二氧化碳能使石灰水中的氢氧化钙反应生成碳酸钙白色沉淀和水,离子方程式:Ca2++2 OH-+CO2=CaCO3↓+H2O;
过量的CO2和澄清石灰水反应生成碳酸氢钙,离子方程式:CO2+OH-=HCO3-,
故答案为:Ca2++2 OH-+CO2=CaCO3↓+H2O或者CO2+OH-=HCO3-.
点评 本题考查了二氧化碳与氢氧化钙反应的离子方程式书写,明确二者反应实质是解题关键,注意反应为用量对离子反应的影响,题目难度不大.

练习册系列答案
相关题目
9.在一容积可变的密闭容器中,通入1mol X和3mol Y,在一定条件下发生如下反应:X(g)+3Y(g)?2Z(g),到达平衡后,Y的体积分数为a%,然后再向容器中通入2mol Z,保持在恒温恒压下反应,当达到新的平衡时,Y的体积分数为b%.则a与b的关系是( )
| A. | a=b | B. | a>b | C. | a<b | D. | 不能确定 |
7.下列叙述中正确的是( )
| A. | 酸碱中和滴定时眼睛要注视着滴定管内液面的变化,以防止滴定过量 | |
| B. | 在海轮外壳上绑上锌块,可减缓外壳腐蚀,这是应用外加电流的阴极保护法来防腐 | |
| C. | 在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,则水分解的热化学方程式为:2H2O (l)═2H2(g)+O(g△H=571.6kJ/mol | |
| D. | 增大反应物浓度,使活化分子百分数增加,化学反应速率增大 |
14.下列判断错误的是( )
| A. | 离子半径:Na+>Mg2+>Al3+ | B. | 还原性:Cl->Br->I- | ||
| C. | 酸性:HClO4>H2SO4>H3PO4 | D. | 碱性:NaOH>Mg(OH)2>Al(OH)3 |
4.羰基硫(COS)存在于许多种植物中,杀虫效果显著.它与CO2、CS2互为等电子体,已知C=O键的键能为745kJ•mol-1,有关硫化羰的说法正确的是( )
| A. | 分子中有2个σ键和1个π键 | |
| B. | 可推测C=S键的键能大于745kJ•mol-1 | |
| C. | COS中碳原子是采用sp2杂化方式成键的 | |
| D. | 分解温度:CS2、COS、CO2依次由低到高 |
8.铟产业被称为“信息时代的朝阳产业”.元素周期表中铟的数据如图,下列说法完全正确的是( )
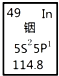

| A. | 铟元素的质量数是114.8 | B. | 铟元素的相对原子质量是114 | ||
| C. | 铟元素是一种副族元素 | D. | 铟原子最外层有3个电子 |