题目内容
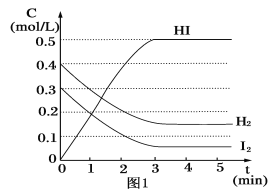
【题目】在某一容积为2L的密闭容器内,加入0.8mol的H2和0.6mol的I2,在一定的条件下发生如下反应:H2(g)+I2(g)![]() 2HI(g)ΔH=-QkJ/mol(Q>0),反应中各物质的浓度随时间变化情况如图1:
2HI(g)ΔH=-QkJ/mol(Q>0),反应中各物质的浓度随时间变化情况如图1:
(1)该反应的化学平衡常数表达式为__。
(2)根据图1数据,反应开始至达到平衡时,平均速率v(HI)为__。
(3)反应达到平衡后,第8分钟时:
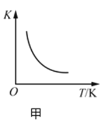
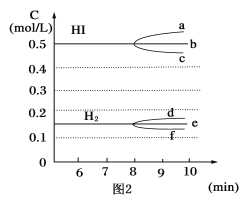
①若升高温度,化学平衡常数K__(填写增大、减小或不变)。HI浓度的变化正确的是__(用图2中a~c的编号回答)。
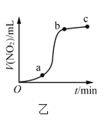
②若加入I2,H2浓度的变化正确的是__(用图2中d~f的编号回答)。
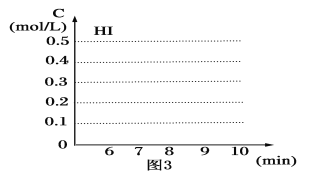
(4)反应达到平衡后,第8分钟时,若把容器的容积扩大一倍,请在图3中画出8分钟后HI浓度的变化情况___。
【答案】K=![]() 0.167mol/(L·min) 减小 c f
0.167mol/(L·min) 减小 c f 
【解析】
(1)化学平衡常数=生成物浓度的系数次方的乘积÷反应物浓度系数次方的乘积;
(2)平均速率v(HI)=![]() ;
;
(3) H2(g)+I2(g)![]() 2HI(g) ΔH<0,升高温度平衡逆向移动;若加入I2,平衡正向移动;
2HI(g) ΔH<0,升高温度平衡逆向移动;若加入I2,平衡正向移动;
(4)反应前后气体系数和相等,若把容器的容积扩大一倍,浓度变为原来一半,平衡不移动;
(1)化学平衡常数=生成物浓度的系数次方的乘积÷反应物浓度系数次方的乘积,H2(g)+I2(g)![]() 2HI(g)反应的平衡常数表达式是K=
2HI(g)反应的平衡常数表达式是K=![]() 。
。
(2)平均速率v(HI)=![]() ,根据图1数据,反应开始至达到平衡时,平均速率v(HI)=
,根据图1数据,反应开始至达到平衡时,平均速率v(HI)=![]() = 0.167mol/(L·min);
= 0.167mol/(L·min);
(3)①H2(g)+I2(g)![]() 2HI(g) ΔH<0,升高温度平衡逆向移动,化学平衡常数K减小,升高温度,平衡逆向移动,HI浓度减小,选c;
2HI(g) ΔH<0,升高温度平衡逆向移动,化学平衡常数K减小,升高温度,平衡逆向移动,HI浓度减小,选c;
②若加入I2,平衡正向移动,H2浓度减小,选f。
(4)反应前后气体系数和相等,若把容器的容积扩大一倍,浓度变为原来一半,平衡不移动,HI浓度的变化情况是 ;
;

【题目】目前世界上60%的镁是从海水中提取的。已知海水提取镁的主要步骤如图:
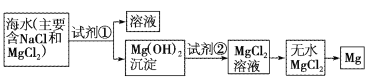
(1)关于加入试剂①作沉淀剂,有以下几种不同方法,请完成下列问题。
方法 | 是否正确 | 简述理由 |
方法1:直接往海水中加入沉淀剂 | 不正确 | 海水中镁离子浓度小,沉淀剂的用量大,不经济 |
方法2:高温加热蒸发海水后,再加入沉淀剂 | 不正确 | (一) |
你认为最合理的其他方法是:(二) | ||
(一)___;
(二)___;
(2)框图中加入的试剂①应该是___(填化学式);加入的试剂②是___(填化学式);工业上由无水MgCl2制取镁的化学方程式为___。
(3)加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是___。