题目内容
 (2013?保定一模)甲酸甲酯水解反应方程武为:HCOOCH3(aq)+H2O(l)?HCOOCH(aq)+CH3OH(aq)△H>0.某温度下,VL溶液中各组分的起始量如表:HCOOCH3转化率随反 应时间(t)的变化如图(假设溶液体积不变)下列说法正确的是( ) (2013?保定一模)甲酸甲酯水解反应方程武为:HCOOCH3(aq)+H2O(l)?HCOOCH(aq)+CH3OH(aq)△H>0.某温度下,VL溶液中各组分的起始量如表:HCOOCH3转化率随反 应时间(t)的变化如图(假设溶液体积不变)下列说法正确的是( )
|
分析:A、已知该反应的△H>0,根据温度对平衡的影响分析;
B、0?10min,HCOOCH3 的转化率为3.0%,根据HCOOCH3的初始量求出反应的量,再求速率;
C、根据图中转化率分析;
D、由图象可知75min时达到平衡.
B、0?10min,HCOOCH3 的转化率为3.0%,根据HCOOCH3的初始量求出反应的量,再求速率;
C、根据图中转化率分析;
D、由图象可知75min时达到平衡.
解答:解:A、已知HCOOCH3(aq)+H2O(l)?HCOOCH(aq)+CH3OH(aq)△H>0,升高温度,平衡正移,平衡常数增大,故A错误;
B、0?10min时,甲酸甲酯转化率为3.0%,所以10min时,参加反应的甲酸甲酯的物质的量为1.00mol×3.0%=0.03mol;则v=
=
mol?L-1?min-1,故B错误;
C、由图可知,10min时转化率为3.0%,15min时转化率为6.7%,20min时转化率为11.2%,相等的时间段内转化率变化的程度增大,说明反应速率增大;50min时转化率为22.9%,75min时转化率为24.0%,转化率变化的程度减小,说明反应速率减小;75min以后转化率不变了,所以达到了平衡状态,故C正确;
D、由图象可知75min以后转化率不变改变,所以达到平衡状态,故D错误;
故选C.
B、0?10min时,甲酸甲酯转化率为3.0%,所以10min时,参加反应的甲酸甲酯的物质的量为1.00mol×3.0%=0.03mol;则v=
| ||
| 10min |
| 0.003 |
| V |
C、由图可知,10min时转化率为3.0%,15min时转化率为6.7%,20min时转化率为11.2%,相等的时间段内转化率变化的程度增大,说明反应速率增大;50min时转化率为22.9%,75min时转化率为24.0%,转化率变化的程度减小,说明反应速率减小;75min以后转化率不变了,所以达到了平衡状态,故C正确;
D、由图象可知75min以后转化率不变改变,所以达到平衡状态,故D错误;
故选C.
点评:本题考查考生对化学反应速率概念,化学平衡的了解及其影响因素的理解,注重考查学生知识迁移、读图及表达能力,难度中等.

练习册系列答案
相关题目

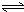 H2SiO3+2OH-(或SiO32-+H2O
H2SiO3+2OH-(或SiO32-+H2O HSiO3-+OH-,HSiO3-+H2O
HSiO3-+OH-,HSiO3-+H2O H2SiO3+OH-,AlO2-+H2O
H2SiO3+OH-,AlO2-+H2O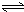 Al(OH)3+OH-),降低pH值有利于平衡向正反应方向移动,当pH调到7~8时,使它们水解完全
Al(OH)3+OH-),降低pH值有利于平衡向正反应方向移动,当pH调到7~8时,使它们水解完全 Cr2O72-+H2O
Cr2O72-+H2O