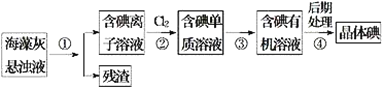
题目内容
【题目】(1)肼(N2H4)又称联氨,在常温下是一种可燃性的液体,可用作火箭燃料。已知在101 kPa时,1 g N2H4在氧气中完全燃烧生成氮气和H2O,放出19.5 kJ热量(25℃时),表示N2H4燃烧的热化学方程式是:______________________________。
(2)在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4 mol液态肼和足量液态H2O2反应,生成氮气和液态水,放出327.05 kJ的热量。写出该反应的热化学方程式:____________________________。
【答案】N2H4(l)+O2(g)===N2(g)+2H2O(l) ΔH=-624 kJ·mol-1 N2H4(l)+2H2O2(l)===N2(g)+4H2O(l) ΔH=-817.625 kJ·mol-1
【解析】
(1)1mol肼质量为32克,完全燃烧生成液态水放出19.5kJ×32=624kJ热量,据此书写热化学反应方程式;
(2)计算1mol液态肼与足量液态双氧水反应时放出的热量,可写出反应的热化学方程式;
(1)1mol纯物质完全燃烧生成稳定的氧化物时放出的热量叫做燃烧热,1mol肼质量为32克,完全燃烧生成液态水放出19.5kJ×32=624kJ热量,该热化学反应方程式为反应放热ΔH为“-”,热化学方程式:N2H4(l)+O2(g)===N2(g)+2H2O(l) ΔH=-624 kJ·mol-1;
(2) 0.4mol N2H4(l)燃烧放出热量为327.05 kJ,1mol液态肼完全反应放出的热量Q=![]() kJ=817.625kJ,该热化学方程式为N2H4(l)+2H2O2(l)===N2(g)+4H2O(l) ΔH=-817.625 kJ·mol-1。
kJ=817.625kJ,该热化学方程式为N2H4(l)+2H2O2(l)===N2(g)+4H2O(l) ΔH=-817.625 kJ·mol-1。

【题目】下列三个化学反应的平衡常数(K1、K2、K3)与温度的关系分别如下表所示:
化学反应 | 平衡常数 | 温度 | |
973K | 1173K | ||
①Fe(s)+CO2(g) | K1 | 1.47 | 2.15 |
②Fe(s)+H2O(g) | K2 | 2.38 | 1.67 |
③CO(g)+H2O(g) | K3 | ? | ? |
则下列说法正确的是
A.△H1<0,△H2>0
B.反应①②③的反应热满足关系:△H2-△H1=△H3
C.反应①②③的平衡常数满足关系:K1·K2=K3
D.要使反应③在一定条件下建立的平衡向正反应方向移动,可采取升温措施