题目内容
【题目】物质A有以下转化关系:
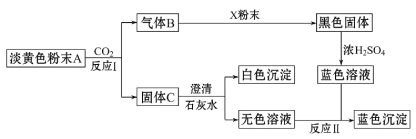
根据上图和实验现象,回答下列问题:(用化学式表示)
(1)A是___________,B是__________,C是__________,X粉末是__________。
(2)确认A中阳离子的实验方法是___________________________________________________。
(3)写出反应Ⅰ的化学方程式_____________________________________。
(4)写出反应Ⅱ的离子方程式_____________________________________。
(5)若参加反应的A的质量为39 g,则消耗CO2的体积(标准状况下)为________L,反应过程中转移电子的物质的量为___________mol。
【答案】Na2O2 O2 Na2CO3 Cu 用焰色反应来检验时,其火焰呈黄色 2Na2O2+2CO2=2Na2CO3+O2 Cu2++2OH-= Cu(OH)2↓ 11.2 0.5
【解析】
能和二氧化碳反应的淡黄色粉末只有过氧化钠,即A为Na2O2,所以B是氧气,固体C是碳酸钠,蓝色溶液是含有铜离子的溶液,可以推知X粉末是金属铜,以此解答。
(1)能和二氧化碳反应的淡黄色粉末只有过氧化钠,即A为Na2O2,所以B是氧气,固体C是碳酸钠,蓝色溶液是含有铜离子的溶液,可以推知X粉末是金属铜,故答案为:Na2O2;O2;Na2CO3;Cu;
(2)A为Na2O2,检验钠离子的方法是焰色反应,其火焰呈黄色,故答案为:用焰色反应来检验时,其火焰呈黄色;
(3)过氧化钠和二氧化碳反应生成碳酸钠和氧气,即2Na2O2+2CO2=2Na2CO3+O2,故答案为:2Na2O2+2CO2=2Na2CO3+O2;
(4)X粉末是金属铜,黑色固体是氧化铜,所以蓝色溶液是硫酸铜,固体C是碳酸钠,和氢氧化钙反应生成碳酸钙和氢氧化钠,氢氧化钠可以和硫酸铜反应生成氢氧化铜和硫酸钠,实质是:Cu2++2OH-=Cu(OH)2↓,故答案为:Cu2++2OH-= Cu(OH)2↓;
(5) 39gNa2O2的物质的量为![]() =0.5mol,根据方程式2Na2O2+2CO2=2Na2CO3+O2可知消耗二氧化碳的物质的量为0.5mol,标况下体积为0.5mol
=0.5mol,根据方程式2Na2O2+2CO2=2Na2CO3+O2可知消耗二氧化碳的物质的量为0.5mol,标况下体积为0.5mol![]() 22.4mol/L=11.2L,Na2O2既是氧化剂也是还原剂,0.5mol过氧化钠参与反应则转移0.5mol电子,故答案为:11.2;0.5。
22.4mol/L=11.2L,Na2O2既是氧化剂也是还原剂,0.5mol过氧化钠参与反应则转移0.5mol电子,故答案为:11.2;0.5。

 天天向上口算本系列答案
天天向上口算本系列答案