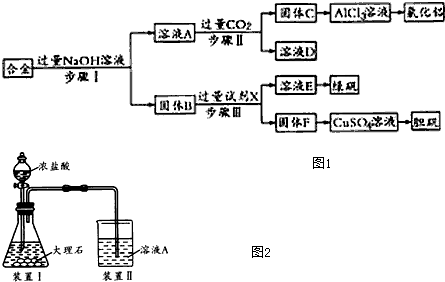
题目内容
11.镁及其化合物有广泛用途.工业上以菱镁矿(主要成分为MgCO3,含SiO2以及少量FeCO3等杂质)为原料制备纳米氧化镁的实验流程如下: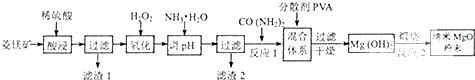
(1)加入H2O2氧化时,发生反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(2)在实验室煅烧滤渣2制得的金属氧化物为Fe2O3(填化学式),需要的仪器除酒精灯、三脚架以外,还需要②③(填序号).
①蒸发皿 ②坩埚 ③泥三角 ④石棉网
(3)在一定条件下CO(NH2)2可与H2O反应生成CO2和一种弱碱,反应的化学方程式为CO(NH2)2+3H2O=CO2↑+2NH3•H2O.
(4)25℃时,加入CO(NH2)2至开始产生沉淀,溶液的pH=10时,c(Mg2+)=1.8×10-3mol•L-1(已知25℃,Ksp[Mg(OH)2]=1.8×10-11).
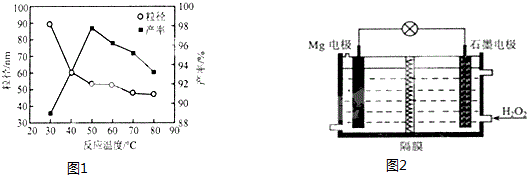
(5)工业上还可用氯化镁和碳酸铵为原料,采用直接沉淀法制务纳米MgO.如图1为反应温度对纳米MgO产率和粒径的影响,据图分析反应的最佳温度为50°C.
(6)Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液,示意图2如下.该电池工作时,石墨电极发生的电极反应为H2O2+2e-=2OH-.
分析 以菱铁矿(主要成分为MgCO3,含少量FeCO3、SiO2)为原料,加入稀硫酸酸溶过滤得到滤液为硫酸镁,硫酸亚铁溶液,滤渣1为SiO2,滤液中加入过氧化氢氧化亚铁离子为铁离子,加入一水合氨调节溶液PH沉淀铁离子,过滤得到滤渣为氢氧化铁沉淀,滤液为硫酸镁溶液,蒸发浓缩,冷却结晶,过滤洗涤制备硫酸镁,加入CO(NH2)2至开始产生沉淀,加入PVA过滤干燥得到氢氧化镁沉淀,高温煅烧制备高纯氧化镁,
(1)过氧化氢氧化亚铁离子为铁离子,易于除去不会引入新的杂质;
(2)上述分析可知煅烧滤渣2为氢氧化铁制得的金属氧化物是氢氧化铁分解生成的氧化铁,灼烧固体需要在坩埚中灼烧;
(3)在一定条件下CO(NH2)2可与H2O反应生成CO2和一种弱碱,依据原子守恒可知弱碱为一水合氨;
(4)依据溶度积计算得到;
(5)图象分析可知在50°C时氧化镁产率最大;
(6)该原电池中,镁作负极,石墨做正极,正极上双氧水得电子生成氢氧根离子;
解答 解:(1)过氧化氢时绿色氧化剂,氧化亚铁离子不会引入新的杂质,氧化亚铁离子的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O;
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(2)煅烧滤渣2为氢氧化铁制得的金属氧化物是氢氧化铁分解生成的氧化铁,化学式为Fe2O3,灼烧固体需要在坩埚中灼烧,需要的仪器除酒精灯、三脚架以外,还需要坩埚、泥三角;
故答案为:Fe2O3,②③;
(3)在一定条件下CO(NH2)2可与H2O反应生成CO2和一种弱碱,依据原子守恒可知弱碱为一水合氨,反应的化学方程式为:CO(NH2)2+3H2O=CO2↑+2NH3•H2O;
故答案为:CO(NH2)2+3H2O=CO2↑+2NH3•H2O;
(4)已知25℃,Ksp[Mg(OH)2]=1.8×10-11),25℃时,加入CO(NH2)2至开始产生沉淀,溶液的pH=10,c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-10}}$=10-4mol/L,Ksp=c(Mg2+)c2(OH-)=1.8×10-11,c(Mg2+)=$\frac{1.8×1{0}^{-11}}{(1{0}^{-4})^{2}}$=1.8×10-3mol/L;
故答案为:1.8×10-3;
(5)图1为反应温度对纳米MgO产率和粒径的影响,据图分析50°C时氧化镁产率最大,反应的最佳温度为
50°C,
故答案为:50° C;
(6)该原电池中,镁作负极,正极上双氧水得电子生成氢氧根离子,电极反应式为H2O2+2e-=2OH-,
故答案为:H2O2+2e-=2OH-.
点评 本题考查了物质分离方法和提纯过程分析判断,原电池原理和电极反应书写,溶度积常数的计算分析,掌握基础是关键,题目难度中等.

| A. | CCl4分子的每个原子都满足8电子稳定结构 | |
| B. | HF的电子式: | |
| C. | 次氯酸的电子式: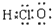 | |
| D. | NaCl的电子式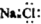 |
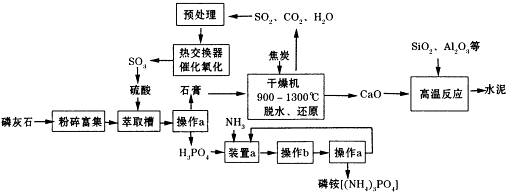
(1)D操作a的名称过滤,实验室中进行此操作时用到的玻璃仪器有漏斗、玻璃棒、烧杯
(2)在实验室中操作b包括蒸发结晶、冷却结晶.
(3)干燥机中发生反应的化学方程式为2CaSO4•2H2O+C$\frac{\underline{\;高温\;}}{\;}$ 2CaO+2SO2↑+CO2↑+4H2O.
(4)水泥常用做建筑材料,是利用了水泥的水硬性性质.
(5)SO2的催化氧化反应为2SO2(g)十02(g)?2S03(g).实验测得压强及温度对S02转化率的影响如下表(原料气各成分的体积分数为SO2:7%、02:11%、N2:82%).
| 压强/Mpa 转化率/% 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
②催化氧化时使用热交换器的原因是移去反应中放出的热量,使反应后的气体降温并预热未反应的气体.
(6)制硫酸所产生的尾气除了含有N2、02外,还含有SO2、微量的S03和酸雾.下列能用于测定硫酸尾气中SO2含量的试剂组是CD.(填写相应字母)
a、NaOH溶液、酚酞试液 b、Na2CO3溶液、酚酞试液 c、碘水、淀粉溶液 d、KMn04溶液、稀硫酸.
请回答下列问题:
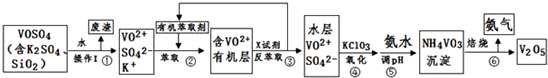
(1)步骤①所得废渣的成分是SiO2(写化学式),操作Ⅰ的名称过滤.
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n(水层)+2nHA(有机层)?2RAn(有机层)+nH2SO4(水层)
②中萃取时必须加入适量碱,其原因是加入碱中和硫酸,促使平衡正向移动,提高钒的萃取率.
③中X试剂为H2SO4.
(3)④的离子方程式为ClO3-+6VO2++9H2O=Cl-+6VO3-+18H+.
(4)25℃时,取样进行试验分 析,得到钒沉淀率和溶液pH之间关系如下表:
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)<2.6×10-3mol•L-1.(已知:25℃时,K电[Fe(OH)3]=2.6×10-33)
(5)该工艺流程中,可以循环利用的物质有有机萃取剂和氨气.
| A. | 分子式相同而结构式不同的化合物互称同分异构体 | |
| B. | 组成元素相同而结构式不同的物质互称同分异构体 | |
| C. | 互为同分异构体的物质性质相同 | |
| D. | 互为同分异构体的物质性质相异 |
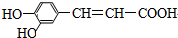
现有①氯化氢 ②溴水 ③纯碱溶液 ④2-丙醇 ⑤酸化的高锰酸钾溶液 ⑥新制氢氧化铜悬浊液.试根据其结构特点判断在一定条件下能与咖啡酸反应的物质组合是( )
| A. | 只有②④⑤⑥ | B. | 只有①③④⑥ | C. | 只有①②③⑤ | D. | ①②③④⑤⑥ |
 某学校实验小组同学欲探究温度对化学平衡的影响,做如下实验:
某学校实验小组同学欲探究温度对化学平衡的影响,做如下实验: