题目内容
K2Cr2O7是一种橙红色且具有强氧化性的化合物,当它被还原成三价铬时,颜色有明显变化.据此,当交通警发现汽车行驶反常时,就上前拦车,并让司机对填充了吸附有K2Cr2O7的硅胶颗粒的装置吹气.若发现硅胶变色达到一定程度时,即证明司机是________.这是因为K2Cr2O7跟________(写化学名称)发生了反应.反应中,当有0.06 mol电子发生转移时,有________mol K2Cr2O7被还原.
答案:酒后驾车,乙醇,0.01
解析:
解析:
|
乙醇(CH3CH2OH)中碳元素平均为-2价,所以乙醇具有还原性,而K2Cr2O7具有强氧化性,硅胶是氧化剂载体,且具有吸附性.当司机饮酒后,口中呼出的气体中含有乙醇气体,乙醇遇到K2Cr2O7会发生氧化还原反应,其反应方程式为:2K2C2O7+CH3CH2OH+8H2SO4=2K2SO4+2Cr2(SO4)3+2CO2+11H2O,由于K2Cr2O7被还原为正三价的铬,而产生明显的颜色改变.还原1 mol K2Cr2O7需要6 mol电子,所以当转移0.06 mol电子时,可还原的K2Cr2O7的物质的量为0.01 mol. |

练习册系列答案
相关题目
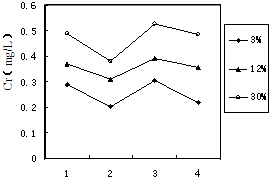 铬(Cr)属于重金属元素,含铬废水和废渣排放必须经过处理达到有关的安全标准.
铬(Cr)属于重金属元素,含铬废水和废渣排放必须经过处理达到有关的安全标准.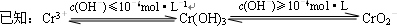 ①FeSO4还原Cr2O72-的离子方程式为
①FeSO4还原Cr2O72-的离子方程式为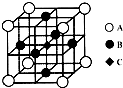 (2013?南通一模)【物质结构与性质】
(2013?南通一模)【物质结构与性质】
