题目内容
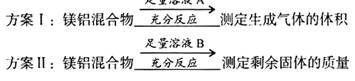
(6分)有一定质量的镁铝合金,将其平均分成两份。第一份加入到100m L盐酸(密度为1.10g/mL)中,恰好完全反应,得到气体4.48L(标准状况);第二份加入到足量NaOH溶液中,得到气体3.36L(标准状况)。求:①原镁铝合金中镁的质量是多少?②
L盐酸(密度为1.10g/mL)中,恰好完全反应,得到气体4.48L(标准状况);第二份加入到足量NaOH溶液中,得到气体3.36L(标准状况)。求:①原镁铝合金中镁的质量是多少?② 盐酸的质量分数是多少?
盐酸的质量分数是多少?
 L盐酸(密度为1.10g/mL)中,恰好完全反应,得到气体4.48L(标准状况);第二份加入到足量NaOH溶液中,得到气体3.36L(标准状况)。求:①原镁铝合金中镁的质量是多少?②
L盐酸(密度为1.10g/mL)中,恰好完全反应,得到气体4.48L(标准状况);第二份加入到足量NaOH溶液中,得到气体3.36L(标准状况)。求:①原镁铝合金中镁的质量是多少?② 盐酸的质量分数是多少?
盐酸的质量分数是多少?(6分)①2.4克;②13.3%。
略

练习册系列答案
相关题目
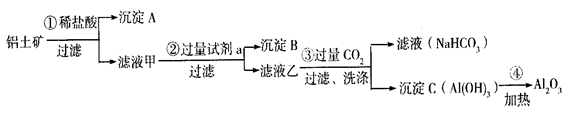
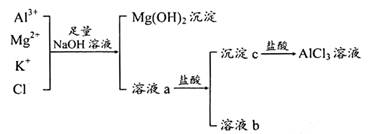
 A、B的成分分别是 、 ;步骤② 中的试剂a是 ;
A、B的成分分别是 、 ;步骤② 中的试剂a是 ; 中存在Fe3+的操作方法:__________ _。
中存在Fe3+的操作方法:__________ _。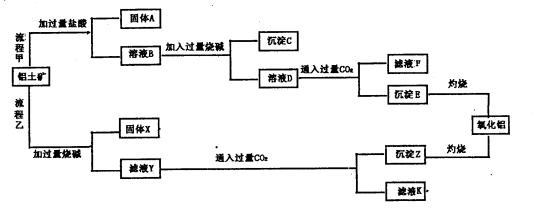
 的离子方程式: .
的离子方程式: .
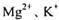 杂质离子并尽可能减少AlCI3的损失:请回答下列问题:
杂质离子并尽可能减少AlCI3的损失:请回答下列问题: