题目内容
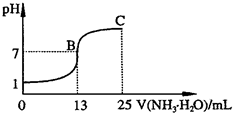
常温下,向25mL 0.1mol·L-1 NaOH溶液中逐滴加入0.1mol·L-1 CH3COOH溶液,曲线如图所示,有关粒子浓度关系正确的是

- A.只有在A、B间任一点,溶液中才有:
c(Na+)+c(H+)=c(CH3COO-)+(OH-) - B.在B点,a>25,且有c(Na+)=c(CH3COO-)>c(OH-)=c(H+)
- C.在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
- D.在D点:c(CH3COO-)+c(CH3COOH)=c(Na+)
BC
考查中和滴定及粒子浓度的浓度
A:混合溶液中只有四种粒子,任何时候都遵循电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+(OH-)
B:当a=25ml时,酸碱恰好中和,生成CH3COONa溶液,水解呈碱性,B点时,溶液pH=7,呈中性,则需要再多加一些醋酸,即a>25ml;中性溶液中,c(OH-)=c(H+),必须有c(Na+)=c(CH3COO-),且c(Na+)=c(CH3COO-)>c(OH-)=c(H+)
C:B点时c(Na+)=c(CH3COO-)>c(OH-)=c(H+),再滴加醋酸,溶液中的c(CH3COO-)、c(H+)增大,则必然导致c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D:D点时醋酸的物质的量为NaOH的两倍,由物质守恒可知c(CH3COO-)+c(CH3COOH)=2c(Na+)
答案为BC
考查中和滴定及粒子浓度的浓度
A:混合溶液中只有四种粒子,任何时候都遵循电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+(OH-)
B:当a=25ml时,酸碱恰好中和,生成CH3COONa溶液,水解呈碱性,B点时,溶液pH=7,呈中性,则需要再多加一些醋酸,即a>25ml;中性溶液中,c(OH-)=c(H+),必须有c(Na+)=c(CH3COO-),且c(Na+)=c(CH3COO-)>c(OH-)=c(H+)
C:B点时c(Na+)=c(CH3COO-)>c(OH-)=c(H+),再滴加醋酸,溶液中的c(CH3COO-)、c(H+)增大,则必然导致c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D:D点时醋酸的物质的量为NaOH的两倍,由物质守恒可知c(CH3COO-)+c(CH3COOH)=2c(Na+)
答案为BC

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 (2011?青岛模拟)氮的化合物在某些领域中扮演着重要的角色.
(2011?青岛模拟)氮的化合物在某些领域中扮演着重要的角色.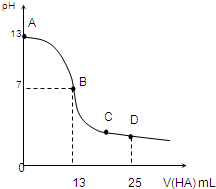 常温下,向25mL 0.1mol/L MOH溶液中逐滴加入0.2mol/L HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:
常温下,向25mL 0.1mol/L MOH溶液中逐滴加入0.2mol/L HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题: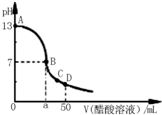 常温下,向25mL 0.1mol?L-1 NaOH溶液中逐滴加入0.1 mol?L-1 CH3COOH溶液,曲线如图所示,有关粒子浓度关系正确的是( )
常温下,向25mL 0.1mol?L-1 NaOH溶液中逐滴加入0.1 mol?L-1 CH3COOH溶液,曲线如图所示,有关粒子浓度关系正确的是( )