题目内容
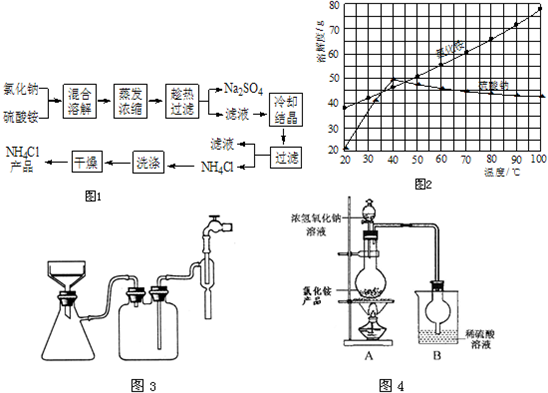
21.以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠,工艺流程如下:
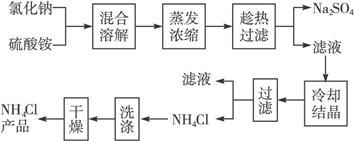
氯化铵和硫酸钠的溶解度随温度变化如下图所示。回答下列问题:

(1)欲制备10.7gNH4Cl,理论上需NaCl g。
(2)实验室进行蒸发浓缩用到的主要仪器有 、烧杯、玻璃棒、酒精灯等。
(3)“冷却结晶”过程中,析出NH4Cl晶体的合适温度为 。
(4)不用其它试剂,检查NH4Cl产品是否纯净的方法及操作是 。
(5)若NH4Cl产品中含有硫酸钠杂质,进一步提纯产品的方法是 。
(1)11.7
(2)蒸发皿
(3)35℃(33~40℃均可)
(4)加热法;取少量氯化铵产品于试管底部,加热,若试管底部无残留物,表明氯化铵产品纯净。
(5)重结晶
解析:本题考查学生对质量守恒定律的理解及对实验室常用仪器用途的了解。由Cl-守恒,NaCl中Cl-来自NH4Cl,10.7 g NH4Cl物质的量为![]() =0.2 mol;NaCl的质量为0.2 mol×58.5 g·mol-1=11.7 g。蒸发主要用到蒸发皿、烧杯、玻璃棒、酒精灯等。在一定水中析出NH4Cl最多,而溶解Na2SO4最多应选择35~40 ℃之间。检验NH4Cl中无Na2SO4的方法是加热,若试管中无残留物表明氯化铵产品纯净。若氯化铵中含有硫酸钠杂质必须进行重结晶。
=0.2 mol;NaCl的质量为0.2 mol×58.5 g·mol-1=11.7 g。蒸发主要用到蒸发皿、烧杯、玻璃棒、酒精灯等。在一定水中析出NH4Cl最多,而溶解Na2SO4最多应选择35~40 ℃之间。检验NH4Cl中无Na2SO4的方法是加热,若试管中无残留物表明氯化铵产品纯净。若氯化铵中含有硫酸钠杂质必须进行重结晶。

练习册系列答案
相关题目