题目内容
【题目】化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。(已知:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O)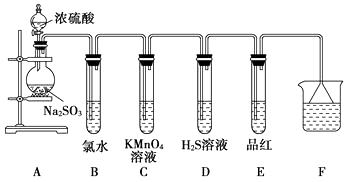
请回答下列问题:
(1)装置A中盛放浓硫酸和亚硫酸钠的仪器名称分别是、。
(2)反应后,装置B中发生的现象是;反应的离子方程式为;装置C中的现象是 , 表现了SO2的;装置D中现象是 , 发生反应的化学方程式为。
(3)装置E的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象。
(4)F装置的作用是 , 漏斗的作用是。
【答案】
(1)分液漏斗,圆底烧瓶
(2)溶液褪色,SO2+Cl2+2H2O=4H++2Cl?+ ![]() ,溶液紫色褪去(溶液褪色),还原性,有黄色沉淀生成,2H2S+SO2=3S↓+2H2O
,溶液紫色褪去(溶液褪色),还原性,有黄色沉淀生成,2H2S+SO2=3S↓+2H2O
(3)将试管E在酒精灯上加热,溶液恢复红色
(4)吸收多余的SO2,防止倒吸
【解析】浓硫酸与Na2SO3发生反应Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O,SO2能使氯水及酸性KMnO4溶液褪色,在反应中SO2表现还原性;SO2与装置D中的H2S发生反应SO2+2H2S=3S↓+2H2O,从而使溶液变浑浊,该反应中SO2表现氧化性;SO2能使品红溶液褪色,但加热后溶液又恢复红色,说明SO2与品红溶液的作用具有可逆性;装置F用于吸收多余的SO2,因为SO2易与NaOH溶液反应,因此采用倒扣漏斗吸收SO2可防止液体倒吸。
根据实验室中制取二氧化硫的反应原理、二氧化硫的还原性和氧化性的实验,以及二氧化硫的漂白性和尾气处理方法进行解答即可.

练习册系列答案
相关题目

