题目内容
下列离子方程式书写正确的是( )
A.将铜屑加入Fe3+溶液中:Fe3++Cu=Fe2++Cu2+
B.NH4HCO3溶液与过量KOH浓溶液共热:NH4++OH- NH3↑+H2O
NH3↑+H2O
C.稀硝酸和过量的铁屑反应:
Fe+4H++NO3-=Fe3++NO↑+2H2O
D.KI溶液与H2SO4酸化的H2O2溶液混合:2I-+H2O2+2H+=I2+2H2O
D
【解析】选项A,得失电子数和电荷不守恒,正确的离子方程式为2Fe3++Cu=2Fe2++Cu2+;KOH过量,则HCO3-也参加离子反应,正确的离子方程式为NH4++HCO3-+2OH- NH3↑+CO32-+2H2O,B项错;铁屑过量,则生成的溶液中不能存在Fe3+,C项错;过氧化氢在酸性条件下能将I-氧化为碘单质,D项正确。
NH3↑+CO32-+2H2O,B项错;铁屑过量,则生成的溶液中不能存在Fe3+,C项错;过氧化氢在酸性条件下能将I-氧化为碘单质,D项正确。

 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案二氧化锰可用作干电池去极剂,合成工业的催化剂和氧化剂,玻璃工业和搪瓷工业的着色剂、消色剂、脱铁剂等。
(1)二氧化锰在酸性介质中是一种强氧化剂,请用化学方程式证明:______________________。
(2)锌—锰碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。电池的总反应式为Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)。
①电池工作时,MnO2发生________反应。
②电池的正极反应式为________。
(3)工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下:
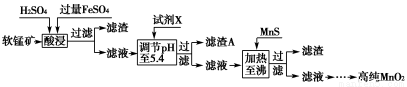
已知:软锰矿的主要成分为MnO2,还含Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物,部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表。
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 |
pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 |
沉淀物 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
pH | 8.0 | -0.42 | 2.5 | 7 | 7 |
回答下列问题:
①硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为________________________。
②试剂X为________。
③滤渣A的主要成分为________。
④加入MnS的目的主要是除去溶液中的________。