题目内容
某Na2CO3、NaAlO2的混合溶液中逐滴加入1 mol·L-1的盐酸,测得溶液中的C 、HC
、HC 、Al
、Al 、Al3+的物质的量与加入盐酸的体积变化关系如图所示,则下列说法正确的是( )
、Al3+的物质的量与加入盐酸的体积变化关系如图所示,则下列说法正确的是( )

 、HC
、HC 、Al
、Al 、Al3+的物质的量与加入盐酸的体积变化关系如图所示,则下列说法正确的是( )
、Al3+的物质的量与加入盐酸的体积变化关系如图所示,则下列说法正确的是( )
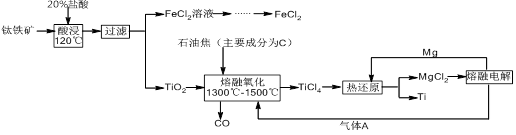
A.原混合溶液中的C 与Al 与Al 的物质的量之比为1∶2 的物质的量之比为1∶2 |
| B.V1∶V2=1∶5 |
| C.M点时生成的CO2为0.05 mol |
D.a线表示的离子方程式为:Al +H++H2O +H++H2O Al(OH)3↓ Al(OH)3↓ |
D
因为酸性有:HCl>H2CO3>HC >C
>C >Al(OH)3,所以在向Na2CO3、NaAlO2的混合溶液中逐滴加入1 mol·L-1的盐酸的过程中,首先发生反应①Al
>Al(OH)3,所以在向Na2CO3、NaAlO2的混合溶液中逐滴加入1 mol·L-1的盐酸的过程中,首先发生反应①Al +H++H2O
+H++H2O Al(OH)3↓,则a线表示的是Al
Al(OH)3↓,则a线表示的是Al 的物质的量,D选项正确,且n(Al
的物质的量,D选项正确,且n(Al )="n(HCl)=0.05" mol;然后发生反应②C
)="n(HCl)=0.05" mol;然后发生反应②C +H+
+H+ HC
HC ,b线表示的是C
,b线表示的是C 的物质的量,c线表示的是HC
的物质的量,c线表示的是HC 的物质的量,n(C
的物质的量,n(C )="n(HCl)=0.05" mol,则n(C
)="n(HCl)=0.05" mol,则n(C )∶n(Al
)∶n(Al )=1∶1,A选项错;V1表示C
)=1∶1,A选项错;V1表示C 与HC
与HC 物质的量相等时加入盐酸的体积,此时V1="75" mL,M表示反应C
物质的量相等时加入盐酸的体积,此时V1="75" mL,M表示反应C +H+
+H+ HC
HC 恰好完成,此时并没有放出CO2,C选项错;再后发生反应③H++HC
恰好完成,此时并没有放出CO2,C选项错;再后发生反应③H++HC
 CO2↑+H2O,HC
CO2↑+H2O,HC 的物质的量对应的是d线,再后发生反应④Al(OH)3+3H+
的物质的量对应的是d线,再后发生反应④Al(OH)3+3H+ Al3++3H2O,Al3+的物质的量对应的是e线,V2="3×50" mL+150 mL="300" mL,V1∶V2=75∶300=1∶4,B选项错。
Al3++3H2O,Al3+的物质的量对应的是e线,V2="3×50" mL+150 mL="300" mL,V1∶V2=75∶300=1∶4,B选项错。
 >C
>C >Al(OH)3,所以在向Na2CO3、NaAlO2的混合溶液中逐滴加入1 mol·L-1的盐酸的过程中,首先发生反应①Al
>Al(OH)3,所以在向Na2CO3、NaAlO2的混合溶液中逐滴加入1 mol·L-1的盐酸的过程中,首先发生反应①Al +H++H2O
+H++H2O Al(OH)3↓,则a线表示的是Al
Al(OH)3↓,则a线表示的是Al 的物质的量,D选项正确,且n(Al
的物质的量,D选项正确,且n(Al )="n(HCl)=0.05" mol;然后发生反应②C
)="n(HCl)=0.05" mol;然后发生反应②C +H+
+H+ HC
HC ,b线表示的是C
,b线表示的是C 的物质的量,c线表示的是HC
的物质的量,c线表示的是HC 的物质的量,n(C
的物质的量,n(C )="n(HCl)=0.05" mol,则n(C
)="n(HCl)=0.05" mol,则n(C )∶n(Al
)∶n(Al )=1∶1,A选项错;V1表示C
)=1∶1,A选项错;V1表示C 与HC
与HC 物质的量相等时加入盐酸的体积,此时V1="75" mL,M表示反应C
物质的量相等时加入盐酸的体积,此时V1="75" mL,M表示反应C +H+
+H+ HC
HC 恰好完成,此时并没有放出CO2,C选项错;再后发生反应③H++HC
恰好完成,此时并没有放出CO2,C选项错;再后发生反应③H++HC
 CO2↑+H2O,HC
CO2↑+H2O,HC 的物质的量对应的是d线,再后发生反应④Al(OH)3+3H+
的物质的量对应的是d线,再后发生反应④Al(OH)3+3H+ Al3++3H2O,Al3+的物质的量对应的是e线,V2="3×50" mL+150 mL="300" mL,V1∶V2=75∶300=1∶4,B选项错。
Al3++3H2O,Al3+的物质的量对应的是e线,V2="3×50" mL+150 mL="300" mL,V1∶V2=75∶300=1∶4,B选项错。
练习册系列答案
相关题目
 Mn2++NO3—+H2O(未配平)。下列叙述中正确的是( )
Mn2++NO3—+H2O(未配平)。下列叙述中正确的是( )