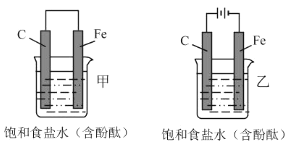
题目内容
【题目】化学电池在通讯、交通及日常生活中有着广泛的应用.目前常用的镍(Ni)镉(Cd)电池,其电池总反应可以表示为:Cd+2NiO(OH)+2H2O![]() 2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法正确的是
2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法正确的是
①以上反应是可逆反应 ②以上反应不是可逆反应
③Cd为电池的正极 ④放电时化学能转变为电能.
A.①③B.②④C.①④D.②③
【答案】B
【解析】
①该二次电池反应条件不同,所以以上反应不是可逆反应,故①错误;
②该二次电池反应条件不同,所以以上反应不是可逆反应,故②正确;
③镉(Cd)为负极,失电子发生氧化反应,故③错误;
④放电时为原电池,化学能转变为电能,故④正确;
答案选B。

 科学实验活动册系列答案
科学实验活动册系列答案【题目】25℃时,三种酸的电离平衡常数如下表所示。
化学式 | CH3COOH | HClO | H3PO3 |
名称 | 醋酸 | 次氯酸 | 亚磷酸 |
电离平衡常数 | 1.8×10-5 | 3.0×10-8 | K1=8.3×10-3 K2 =5.6×10-6 |
回答下列问题:
(1)浓度均为0.1 molL-1的CH3COOH 、HClO 、H3PO3溶液中,c(H+)最小的是_____________。
(2)亚磷酸(H3PO3)为二元酸,具有较强的还原性。H3PO3的第二级电离方程式为________________。Na2HPO3是_____________(填“酸式盐”“碱式盐”或“正盐”)。
(3)常温下,0.1 molL-1的CH3COOH溶液加水稀释的过程中,下列表达式的数值变大的是______(填字母)。
A.c(H+) B.  C.c(CH3COO-) D.c(CH3COOH)
C.c(CH3COO-) D.c(CH3COOH)
(4)体积均为10mL、c(H+)均为10-2 mol L-1的醋酸溶液与一元酸HX分别加水稀释至1000 mL,稀释过程中c(H+)的变化如图所示,则HX的电离平衡常数_______________(填“大于”“ 小于”或“等于”)醋酸的电离平衡常数,理由是____________________________。