题目内容
【题目】氮元素可以形成多种氢化物,如NH3、N2H4等。
(1)工业上,可用次氯酸钠与氨反应制备N2H4(肼),副产物对环境友好,写出反应的化学方程式________。
(2)工业上以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(g),该反应的平衡常数和温度关系如图所示:
CO(NH2)2(l)+H2O(g),该反应的平衡常数和温度关系如图所示:

①该反应的ΔH_____0(填“>”或“<”)。
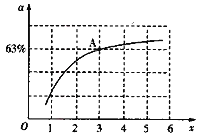
②已知原料气中的氨碳比[![]() ]为x,CO2的平衡转化率为a,在一定温度和压强下,a与x的关系如图所示。a随着x的增大而增大的原因是______。图中A点处,NH3的平衡转化率为__________。
]为x,CO2的平衡转化率为a,在一定温度和压强下,a与x的关系如图所示。a随着x的增大而增大的原因是______。图中A点处,NH3的平衡转化率为__________。
(3)①在氨水加水稀释的过程中,NH3·H2O的电离程度增大,![]() 的值_______。(填“增大”、“减小”或“不变”,)
的值_______。(填“增大”、“减小”或“不变”,)
②室温下,amol/L的(NH4)2SO4溶液的pH=5,原因是_____(用离子方程式表示),该反应的平衡常数为______(用含a的数学表达式表示)。
【答案】2NH3+NaClO=N2H4+NaCl+H2O < 增大c(NH3),平衡正向移动,从而提高CO2的转化率 42% 不变 NH4++H2O![]() NH3·H2O+H+
NH3·H2O+H+ ![]()
【解析】
(1)由题,NH3和NaClO反应副产物对环境无污染,可知产物为NaCl和H2O,反应方程式为:2NH3+NaClO=N2H4+NaCl+H2O;
(2)①由表中数据可知,温度越高,平衡常数越小,说明反应为放热反应,即ΔH<0;
②x增大说明NH3含量增加,即增大了c(NH3),平衡正向移动,从而提高CO2的转化率,故a随着x的增大而增大;由图A点处x=3,若假设原料气中n(CO2) =1mol,则n(NH3)=3mol,又CO2的转化率为63%,即CO2反应了0.63mol,由题给反应方程式可知NH3反应了1.26mol,所以NH3的转化率为:![]() ;
;
(3)①由题: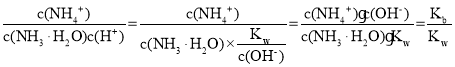 ,其中Kb表示NH3·H2O的电离平衡常数,Kw表示水的离子积常数,在温度不变的情况下,数值不变,故
,其中Kb表示NH3·H2O的电离平衡常数,Kw表示水的离子积常数,在温度不变的情况下,数值不变,故![]() 的值不变;
的值不变;
②(NH4)2SO4溶液的pH=5,原因是NH4+发生水解,离子方程式为:NH4++H2O![]() NH3·H2O+H+;amol/L的(NH4)2SO4溶液的pH=5,故c(H+)=10-5mol/L,故c(NH3·H2O)=10-5mol/L,又NH4+发生水解部分不计,故c(NH4+)=2amol/L,所以平衡常数为:
NH3·H2O+H+;amol/L的(NH4)2SO4溶液的pH=5,故c(H+)=10-5mol/L,故c(NH3·H2O)=10-5mol/L,又NH4+发生水解部分不计,故c(NH4+)=2amol/L,所以平衡常数为: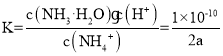

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案【题目】一定温度下,在2 L的恒容密闭容器中发生反应![]() 。反应过程中的部分数据如下表所示:
。反应过程中的部分数据如下表所示:
n/mol t/min |
|
|
|
0 | 2.0 | 2.4 | 0 |
5 | 0.9 | ||
10 | 1.6 | ||
15 | 1.6 |
下列说法正确的是( )
A.0~5 min用A表示的平均反应速率为![]()
B.该反应在10 min后才达到平衡
C.平衡状态时,![]()
D.物质B的平衡转化率为20%