题目内容
【题目】2008年初我国南方遭遇的冰雪灾害中,使用了一种融雪剂,其主要成分的化学式为XY2,X原子的结构示意图![]() X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
(1)m=________,该融雪剂的化学式为________。
(2)Z、W元素的名称为________、_______。
(3)下列说法正确的是________。
A.XY2和WZ2都为离子化合物
B.XY2分子中仅含离子键,WZ2中仅含极性共价键
C.H2Z比HY的稳定性强
D.X的阳离子比Y的阴离子半径大
(4)下列化学用语表达正确的是________。
A.XY2的电子式:![]()
B.WZ2的结构式:Z=W=Z
C.Y元素的单质与H2Z水溶液反应的离子方程式为:Y2+Z2-=2Y+Z↓
D.用电子式表示XY2的形成过程为:![]()
(5)冰雪的化学成分是H2O,水的沸点比H2Z的沸点高,其原因是_________________。
【答案】(1)20 CaCl2
(2)硫;碳;
(3)B
(4)BD
(5)水分子之间含有氢键
【解析】试题分析:X原子的结构示意图![]() ,根据核外电子排布规律,a=2,b=8,X是钙元素;X的阳离子与Y的阴离子的电子层结构相同,Y显-1价,Y是氯元素;Z原子的最外层电子数均是其电子层数的2倍,Z与Y相邻,Z是硫元素;W均为短周期元素,原子的最外层电子数均是其电子层数的2倍, Z、W能形成一种WZ2型分子,W是碳元素;
,根据核外电子排布规律,a=2,b=8,X是钙元素;X的阳离子与Y的阴离子的电子层结构相同,Y显-1价,Y是氯元素;Z原子的最外层电子数均是其电子层数的2倍,Z与Y相邻,Z是硫元素;W均为短周期元素,原子的最外层电子数均是其电子层数的2倍, Z、W能形成一种WZ2型分子,W是碳元素;
(1)m=20,该融雪剂的化学式为CaCl2。
(2)Z、W元素的名称为硫;碳。
(3) CS2是共价化合物;CaCl2中仅含离子键,CS2中仅含极性共价键
C.HCl比H2S的稳定稳定性强 ;![]() 比
比![]() 半径小;
半径小;
(4)下列化学用语表达正确的是________。
A.XY2的电子式:![]()
B.WZ2的结构式:S=C=S
C.氯气与H2S水溶液反应的离子方程式为:Cl2+H2S=2HCl+S↓
D.用电子式表示XY2的形成过程为:![]()
(5)冰雪的化学成分是H2O,水的沸点比H2Z的沸点高,其原因是水分子之间含有氢键。

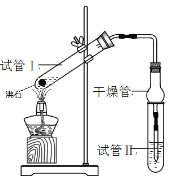
【题目】乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。某学生在实验室利用下图的实验装置制备乙酸乙酯并研究其反应条件。
物质 | 沸点/C | 密度/gcm3 |
乙醇 | 78.0 | 0.79 |
乙酸 | 117.9 | 1.05 |
乙酸乙酯 | 77.5 | 0.90 |
异戊醇 | 131 | 0.8123 |
乙酸异戊酯 | 142 | 0.8670 |
实验步骤如下:
① 配制反应混合液:2mL浓H2SO4、3mL乙醇、2mL乙酸
② 按图连接实验装置并检验气密性
③ 分别在试管1、试管2中加入反应液
④ 用酒精灯微热3min,再加热使之微微沸腾3min
⑤ 分离提纯乙酸乙酯
(1)在试管1中加入物质分别是:______________(按着加入的先后顺序写出名称),乙醇过量的目的是:_______________;
(2)该反应的平衡常数表达式K=______________;
(3)试管Ⅱ中所盛试剂为___________,欲将其物质分离使用的仪器为___________,在充分振荡的过程中,发生的反应为________________;
(4)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用右图所示装置进行了以下四个实验,实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如下:
实验编号 | 试管Ⅰ中的试剂 | 测得有机层的厚度/cm |
A | 2mL乙醇、2mL乙酸、1mL 18mol/L浓硫酸 | 5.0 |
B | 3mL乙醇、2mL乙酸 | 0.1 |
C | 3mL乙醇、2mL乙酸、6mL 3mol/L硫酸 | 1.2 |
D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是_________mL和_________mol/L;
②分析实验________(填实验编号)的数据,可以推测出浓硫酸的吸水性提高了乙酸乙酯的产率。浓硫酸的吸水性能够提高乙酸乙酯产率的原因是____________;
③加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是_______________;
(5)若利用该装置制备乙酸异戊酯,产物将主要在装置中_______的得到,那么产率会_____(“较高”或“偏低”);