题目内容
26.水垢可以看作由多种物质组成的混合物,为研究含有Ca2+、Mg2+、HCO3—的水所形成水垢的化学组成,取干燥的水垢6.32g,加热使其失去结晶水,得到5.78g剩余固体A;高温灼烧A至恒重,残余固体为CaO和MgO,放出的气体用过量的Ba(OH)2溶液吸收,得到11.82g沉淀。⑴ 通过计算确定A中是否含有碳酸镁;
⑵ 5.78g剩余固体A灼烧至恒重时产生的气体完全被碱石灰吸收,碱石灰增重2.82g,通过计算确定A中各成分的物质的量,并计算出水垢中碳酸盐的质量分数。
答案:(1)一定含有MgCO3
(2)82.3%
解析:(1)根据题意n(CO2)=n(BaCO3)=![]() =0.06 mol
=0.06 mol
若CO2全部来自于CaCO3的分解。
则m(CaCO3)=0.06 mol×100 g·mol-1=6.00 g>5.78 g不合题意;所以,A中一定含有MgCO3。
(2)m(CO2)=0.06 mol×44 g·mol-1=2.64 g
m(H2O)=2.82 g-2.64 g=0.18 g
n〔Mg(OH)2〕=n(H2O)=![]() =0.01 mol
=0.01 mol
m〔Mg(OH)2〕=0.01 mol×58 g·mol-1=0.58 g
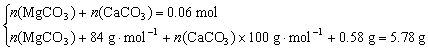
解得n(MgCO3)=0.05 mol n(CaCO3)=0.01 mol
![]() ×100%=82.3%
×100%=82.3%

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目