题目内容
水垢可以看作由多种物质组成的混合物,为研究含有Ca2+、Mg2+、HCO3- 的水所形成的水垢的化学组成,取干燥的水垢6.32g,加热使其失去结晶水,得到5.78g剩余固体A;高温灼烧A至恒重,残余固体为CaO和MgO,放出的气体用过量的Ba(OH)2溶液吸收,得到11.82g沉淀。(1)通过计算确定A中是否含有碳酸镁。
(2)5.78g剩余固体A灼烧至恒重时产生的气体完全被碱石灰吸收,碱石灰增重2.82g,通过计算确定A中各成分的物质的量,并计算出水垢中碳酸盐的质量分数。
(1)根据题意,n(CO2)=n(BaCO3)=
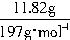 =0.06mol。
=0.06mol。若CO2全部来自CaCO3的分解,则m(CaCO3)=0.06mol×100g/mol=6.00g>5.78g,不合题意。所以,A中一定含有MgCO3。
(2)m(CO2)=0.06mol×44g/mol=2.64g
m(H2O)=2.82g-2.64g=0.18g
n[Mg(OH)2]=n(H2O)=
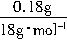 =0.01mol
=0.01molm[Mg(OH)2]=0.01mol×58g/mol=0.58g
n(CaCO3)+n(MgCO3)=0.06mol
n(CaCO3)×100g/mol+n(MgCO3)×84g/mol+0.58g=5.78g
解得:n(MgCO3)=0.05mol,n(CaCO3)=0.01mol。
ω(碳酸盐)=[(0.05mol×84g?mol-1+0.01mol×100g?mol-1)÷6.32g]×100%=82.3%。
【试题分析】

练习册系列答案
相关题目