题目内容
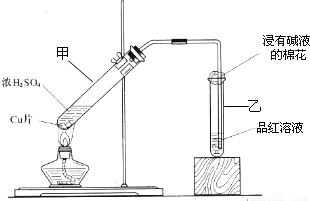
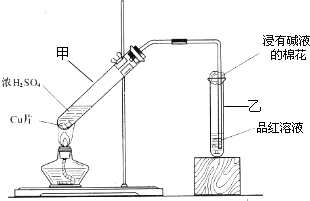
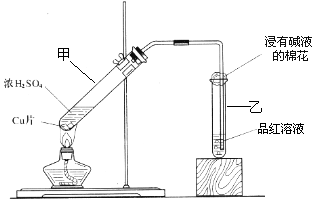
 某教师在课堂上用右图所示的装置来验证浓硫酸与铜是否发生反应,并探讨反应所产生气体的性质.请答下列问题:
某教师在课堂上用右图所示的装置来验证浓硫酸与铜是否发生反应,并探讨反应所产生气体的性质.请答下列问题:
(1)通过试管乙中发生的______
现象说明了铜和浓硫酸发生了化学反应,
并且该现象还能说明产生的气体具有______性.
(2)写出试管甲中所发生反应的化学方程式,并标明电子转移方向和数目______.
(3)试管乙口部浸有碱液的棉花的作用是______,此防范措施也说明产生的气体是______(填“酸性”、“中性”或“碱性”)气体,______(填“有”或“无”)毒性.
(4)SO2的排放是造成酸雨的主要因素,某同学通过实验探究,得出酸雨pH随时间的增加而减小的结论.为进一步研究酸雨的成分,该同学取某一时段的这种雨水V L,加入0.5mol/L的Ba(OH)2溶液至不再产生沉淀时,恰好消耗40.00mL Ba(OH)2溶液.请计算:
①该雨水中共溶解SO2的体积是______mL(标准状况).
②若生成沉淀物的质量为4.50g,则沉淀物的组成为______(填写化学式).
解:(1)金属铜和浓硫酸发生反应生成硫酸铜、水和二氧化硫,生成的二氧化硫能使品红褪色,说明二氧化硫具有漂白性,故答案为:品红溶液褪色;漂白;
(2)金属铜和浓硫酸发生反应生成硫酸铜、水和二氧化硫Cu+2H2SO4 CuSO4+SO2↑+2H2O,化合价的升高值=化合价的降低值=转移电子数=2,电子转移情况如下:
CuSO4+SO2↑+2H2O,化合价的升高值=化合价的降低值=转移电子数=2,电子转移情况如下: ,故答案为:
,故答案为: ;
;
(3)二氧化硫有毒,属于酸性氧化物,能和碱反应生成盐和水,在装置口处浸有碱液的棉花可以和二氧化硫反应,故答案为:吸收SO2;酸性;有;
(4)①二氧化硫和氢氧化钡的反应方程式为:SO2+Ba(OH)2=BaSO3↓+H2O,设该雨水中共溶解SO2的体积是x,则
SO2 +Ba(OH)2=BaSO3↓+H2O
1 1
 0.5 mol/L×0.04L
0.5 mol/L×0.04L
则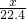 =0.02,解得x=0.448L=448mL,故答案为:448;
=0.02,解得x=0.448L=448mL,故答案为:448;
②0.5mol/L、40.00mL 的Ba(OH)2溶液和二氧化硫反应,如果全部转化为亚硫酸钡,根据钡原子守恒,则生成亚硫酸钡的质量为:0.02mol×217g/mol=4.34g,如果全部转化为硫酸钡,根据钡原子守恒,则生成硫酸钡的质量为:0.02mol×233g/mol=4.66g,4.34g<4.50g<4.66g,所以沉淀物的组成为BaSO3和BaSO4,故答案为:BaSO3和BaSO4.
分析:(1)金属铜和浓硫酸发生反应生成硫酸铜、水和二氧化硫,二氧化硫能使品红褪色,具有漂白性;
(2)金属铜和浓硫酸发生反应生成硫酸铜、水和二氧化硫,根据化合价的升高值=化合价的降低值=转移电子数来标电子转移情况;
(3)二氧化硫有毒,属于酸性氧化物,能和碱反应;
(4)根据二氧化硫和氢氧化钡的反应方程式进行计算.
点评:本题考查学生浓硫酸的性质以及二氧化硫的性质,可以根据所学知识进行回答,难度较大.
(2)金属铜和浓硫酸发生反应生成硫酸铜、水和二氧化硫Cu+2H2SO4
 CuSO4+SO2↑+2H2O,化合价的升高值=化合价的降低值=转移电子数=2,电子转移情况如下:
CuSO4+SO2↑+2H2O,化合价的升高值=化合价的降低值=转移电子数=2,电子转移情况如下: ,故答案为:
,故答案为: ;
;(3)二氧化硫有毒,属于酸性氧化物,能和碱反应生成盐和水,在装置口处浸有碱液的棉花可以和二氧化硫反应,故答案为:吸收SO2;酸性;有;
(4)①二氧化硫和氢氧化钡的反应方程式为:SO2+Ba(OH)2=BaSO3↓+H2O,设该雨水中共溶解SO2的体积是x,则
SO2 +Ba(OH)2=BaSO3↓+H2O
1 1
 0.5 mol/L×0.04L
0.5 mol/L×0.04L则
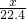 =0.02,解得x=0.448L=448mL,故答案为:448;
=0.02,解得x=0.448L=448mL,故答案为:448;②0.5mol/L、40.00mL 的Ba(OH)2溶液和二氧化硫反应,如果全部转化为亚硫酸钡,根据钡原子守恒,则生成亚硫酸钡的质量为:0.02mol×217g/mol=4.34g,如果全部转化为硫酸钡,根据钡原子守恒,则生成硫酸钡的质量为:0.02mol×233g/mol=4.66g,4.34g<4.50g<4.66g,所以沉淀物的组成为BaSO3和BaSO4,故答案为:BaSO3和BaSO4.
分析:(1)金属铜和浓硫酸发生反应生成硫酸铜、水和二氧化硫,二氧化硫能使品红褪色,具有漂白性;
(2)金属铜和浓硫酸发生反应生成硫酸铜、水和二氧化硫,根据化合价的升高值=化合价的降低值=转移电子数来标电子转移情况;
(3)二氧化硫有毒,属于酸性氧化物,能和碱反应;
(4)根据二氧化硫和氢氧化钡的反应方程式进行计算.
点评:本题考查学生浓硫酸的性质以及二氧化硫的性质,可以根据所学知识进行回答,难度较大.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
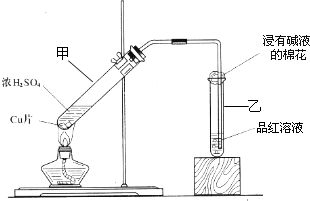 某教师在课堂上用右图所示的装置来验证浓硫酸与铜是否发生反应,并探讨反应所产生气体的性质.请答下列问题:
某教师在课堂上用右图所示的装置来验证浓硫酸与铜是否发生反应,并探讨反应所产生气体的性质.请答下列问题: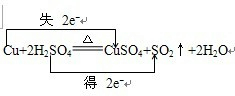
 应,并探讨反应所产生气体的性质。请
应,并探讨反应所产生气体的性质。请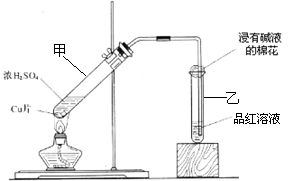 的装置来验证浓硫酸与铜是否发生反
的装置来验证浓硫酸与铜是否发生反