��Ŀ����
����Ŀ������̼�����Ҫ����ʳƷ��ҽҩ����ҵ���Ծ�ѡʯ��ʯ����������MgCO3��FeCO3���ʣ�Ϊԭ���Ʊ�����̼��ƵĹ����������£�

��1�������п���ѭ�����õ������������������__________���ѧʽ����
��2����̼����ʱ������Ӧ�����ӷ���ʽΪ________________���ù�����ͨ��������������˳����________________��
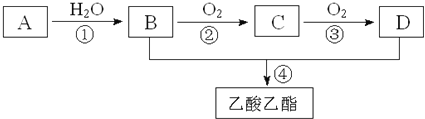
��3����ҵ�ϳ��õ���Ȼ��ƺ��Ȼ������������Ʊ������ƣ�ԭ������ͼ��ʾ��

�ٵ������У������Ȼ��Ƶ�Ŀ����________________��
��ʯī�缫�����ĵ缫��Ӧ����ʽΪ________________��
�۵��õ���Na��Լ��1%��Ca����ȥ��������Ca�ķ���Ϊ________________��
��֪�������ʵ��۷е����±���

���𰸡� NH4Cl Ca2+ + CO2 + 2NH3 + H2O��CaCO3�� + 2NH4+ ��ͨ�������������ͨ����� ���͵���ʵ������¶ȣ������ܺ� 2Cl����2e����Cl2�� �����¶���370K��1123K������
����������ѡʯ��ʯ���յõ�����þ�����������������ƺ�����������̼����������Ȼ�什�ȡ����˫��ˮ������ȷ����������ת��Ϊ�����ӣ��ټ��������Ƶ���pH�����������·�Ӧ�õ������Ϊ��������ʹ�����ӡ�þ����ת��Ϊ���������ˣ�����Ϊ����������������þ�����˺����Һ���Ȼ���Ϊ���ʣ���ͨ�������İ�������ͨ�������Ķ�����̼���õ��Ȼ�狀�̼��ƣ����˵õ���ҺΪ�Ȼ�泥�����Ϊ̼��ơ�
��1���ù����п���ѭ��ʹ�õ������Dzμӷ�Ӧ���̣���Ӧ�������ɵ����ʿ���ѭ��ʹ�ã�����ͼ�����ж�����������ֱ�Ϊ������̼�Ͱ���������ѭ��ʹ�ã�������ҺNH4ClҲ����ѭ��ʹ�ã���2����̼����ʱ�Ȼ�����Һ��ͨ�백���Ͷ�����̼����̼��ƺ��Ȼ�泥�������Ӧ�����ӷ���ʽΪCa2+ + CO2 + 2NH3 + H2O��CaCO3�� + 2NH4+�������ܽ�ȴ�Ϊ��֤�ܽ�������壬�ù�������ͨ�������������ڼ�����Һ��ͨ�������3���ٵ������У������Ȼ��Ƶ�Ŀ���ǽ��͵���ʵ������¶ȣ������ܺģ�����Ϊ���ý���������Ȼ�������ʱ������Ϊ��������ʯī�缫Ϊ�����������ĵ缫��Ӧ����ʽΪ2Cl����2e����Cl2�����۵��õ���Na��Լ��1%��Ca����ȥ��������Ca�ķ���Ϊ�����¶���370K��1123K������