题目内容
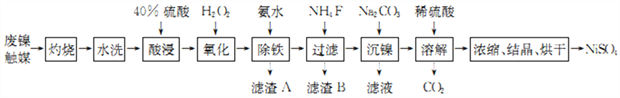
【题目】锰及其化合物在生产、生活中有许多用途。在实验室中模拟工业利用软锰矿(主要成分为MnO2,含少量SiO2、Fe2O3和Al2O3等)制备金属锰等物质,设计流程如下:

己知:Mn2+有较强的还原性,在空气中能被氧气氧化,碳酸锰在空气中高温加热固体产物为Mn2O3;部分氢氧化物的Ksp(近似值)如下表。
物质 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 |
Ksp | 10-13 | 10-17 | 10-39 | 10-33 |
(1)“酸浸”前需将软锰矿粉碎的目的是_____________;酸浸过程MnO2发生反应的离子方程式为_________________。
(2)向滤液I中需先加A物质,再加B物质,若加入的物质均为非金属化合物的溶液,则A为(填物质的名称)_________,B为(填物质的名称)________。滤渣II的成分是_______(填物质的化学式)。
(3)“酸浸”需适宜的酸浓度、液固比、酸浸温度等,其中浸取率随酸浸时间的变化如图所示:

当浸取时间超过4h时,锰浸取率反而减小,其原因是______________。
(4)测得滤液I中c(Mn2+)=0.1mo/L,则加入B调节溶液pH范围为______。(已知:当某种离子浓度小于1×10-5mo/L时,可认为其沉淀完全。结果保留两位小数)
(5)“沉锰”过程中加入氨水的目的是(从化学平衡移动的角度解释)______________。
(6)写出由MnCO3为原料制备金属锰的过程中所涉及的化学方程式:____________。
【答案】 增大反应物接触面积,加快反应速率,提高原料利用率 MnO2+2Fe2++4H+ ![]() Mn2++2Fe3++2H2O 双氧水(或过氧化氢) 氨水 Fe(OH)3、 Al(OH)3 Mn2+被空气中的氧气氧化,从而使浸取率降低 4.67≤pH<8.00(或 4.67<pH<8.00) Mn2++HCO3-
Mn2++2Fe3++2H2O 双氧水(或过氧化氢) 氨水 Fe(OH)3、 Al(OH)3 Mn2+被空气中的氧气氧化,从而使浸取率降低 4.67≤pH<8.00(或 4.67<pH<8.00) Mn2++HCO3-![]() MnCO3+H+,氨水消耗了 H+, 促进反应平衡正向移动,有利于MnCO3的生成 4MnCO3+ O2
MnCO3+H+,氨水消耗了 H+, 促进反应平衡正向移动,有利于MnCO3的生成 4MnCO3+ O2![]() 2Mn2O3 + 4CO2 Mn2O3+2Al
2Mn2O3 + 4CO2 Mn2O3+2Al![]() Al2O3 + 2Mn
Al2O3 + 2Mn
【解析】考查化学工艺流程,(1)粉碎的目的是增大反应物的接触面积,加快反应速率,提高原料的利用率;根据流程,酸浸加入FeSO4,Fe2+具有还原性,MnO2具有强氧化性,因此发生的反应的有MnO2+2Fe2++4H+![]() Mn2++2Fe3++2H2O;(2)根据流程图,酸浸加入FeSO4是过量,以及物质的Ksp,因此先把Fe2+氧化成Fe3+,因此A和B均为非金属化合物的溶液,因此A为H2O2,名称为过氧化氢,然后调节pH,让Al3+、Fe3+转化成沉淀,因此B为NH3·H2O,名称为氨水,滤渣II为Al(OH)3、Fe(OH)3;(3)根据信息,Mn2+具有较强的还原性,在空气中能被氧气氧化,因此超过4小时后,锰的浸取率减小的原因是Mn2+被空气中氧气氧化,从而使浸取率降低;(4)Fe3+全部沉淀时的溶液中c(OH-)=
Mn2++2Fe3++2H2O;(2)根据流程图,酸浸加入FeSO4是过量,以及物质的Ksp,因此先把Fe2+氧化成Fe3+,因此A和B均为非金属化合物的溶液,因此A为H2O2,名称为过氧化氢,然后调节pH,让Al3+、Fe3+转化成沉淀,因此B为NH3·H2O,名称为氨水,滤渣II为Al(OH)3、Fe(OH)3;(3)根据信息,Mn2+具有较强的还原性,在空气中能被氧气氧化,因此超过4小时后,锰的浸取率减小的原因是Mn2+被空气中氧气氧化,从而使浸取率降低;(4)Fe3+全部沉淀时的溶液中c(OH-)=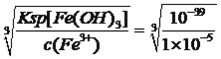 =10-11.3mol·L-1,则c(H+)=10-2.7mol·L-1,即pH=2.7,Al3+全部转化成沉淀时,溶液中c(OH-)=
=10-11.3mol·L-1,则c(H+)=10-2.7mol·L-1,即pH=2.7,Al3+全部转化成沉淀时,溶液中c(OH-)=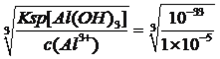 =10-9.33mol·L-1,则c(H+)=10-4.67mol·L-1,即pH=4.67,Mn2+开始出现沉淀时,c(OH-)=
=10-9.33mol·L-1,则c(H+)=10-4.67mol·L-1,即pH=4.67,Mn2+开始出现沉淀时,c(OH-)=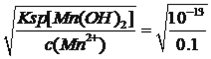 =10-6mol·L-1,则pH=8.0,因此加入NH3·H2O调节pH的范围是4.67≤pH<8.00(或 4.67<pH<8.00);(5)根据流程图,沉锰中Mn2+转化成MnCO3,因此发生的反应是Mn2++HCO3-
=10-6mol·L-1,则pH=8.0,因此加入NH3·H2O调节pH的范围是4.67≤pH<8.00(或 4.67<pH<8.00);(5)根据流程图,沉锰中Mn2+转化成MnCO3,因此发生的反应是Mn2++HCO3-![]() MnCO3+H+,加入氨水,消耗H+,平衡向正反应方向生成,有利于MnCO3生成;(6)根据信息,MnCO3在空气中高温加热固体产物为Mn2O3,化学反应方程式为4MnCO3+O2
MnCO3+H+,加入氨水,消耗H+,平衡向正反应方向生成,有利于MnCO3生成;(6)根据信息,MnCO3在空气中高温加热固体产物为Mn2O3,化学反应方程式为4MnCO3+O2![]() 2Mn2O3+4CO2,得到金属锰,常用Al作还原剂,发生的反应是Mn2O3+2Al
2Mn2O3+4CO2,得到金属锰,常用Al作还原剂,发生的反应是Mn2O3+2Al![]() Al2O3 + 2Mn。
Al2O3 + 2Mn。