��Ŀ����
����Ŀ��ú̿����ת��Ϊ�����Դ�ͻ���ԭ�ϣ�
��1����ú�����Ƶ�ˮú������ҵ�Ͽ���ú��ˮͨ��ˮú��������������֪�����Ȼ�ѧ����ʽ��
C��s��+ ![]() O2��g���TCO��g����H1=��110.5kJmol��1
O2��g���TCO��g����H1=��110.5kJmol��1
2H2��g��+O2��g���T2H2O��g����H2=��483.6kJmol��1
����ˮú�����������ķ�Ӧ�ķ�Ӧ�ȡ�H3 ��
C��s��+H2O��g���TCO��g��+H2��g����H3=kJmol��1
��2����H��H��O=O��O��H���ļ��ֱܷ���436kJmol��1��496kJmol��1��m kJmol��1 �� ��������Ȼ�ѧ����ʽ��������ݼ��㣬m= ��
��3����֪һ����̼��ˮ������Ӧ���̵������仯��ͼ��ʾ����˷�ӦΪ������ȡ����ȡ�����Ӧ����Ӧ���Ȼ�ѧ����ʽΪ �� 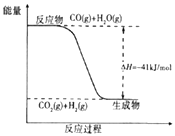
���𰸡�
��1��+131.3
��2��462.9
��3�����ȣ�CO��g��+H2O��g��=CO2��g��+H2��g����H=��41 kJ/mol
���������⣺��1����C��s��+ ![]() O2��g��=CO��g����H1=��110.5kJ/mol
O2��g��=CO��g����H1=��110.5kJ/mol
��2H2��g��+O2��g��=2H2O��g����H2=��483.6kJ/mol
���ݸ�˹���ɢ٩� ![]() �õ���C��s��+H2O��g��=CO��g��+H2��g����H3=+131.3KJ/mol��
�õ���C��s��+H2O��g��=CO��g��+H2��g����H3=+131.3KJ/mol��
���Դ��ǣ�+131.3����2����֪�٣�C��s��+H2O��g��=CO��g��+H2��g����H3=+131.3KJ/mol����C��s��+ ![]() O2��g���TCO��g����H1=��110.5kJmol��1
O2��g���TCO��g����H1=��110.5kJmol��1
�١�2���ڡ�2�ã�2H2O��g���TO2��g��+2H2��g����H=��2��131.3KJ+221��kJmol��1 ��
4��m��496��2��436=2��131.3KJ+221��
���m=+462.9�����Դ��ǣ�462.9����3��ͼ������жϷ�Ӧ������������������������Ӧ�Ƿ��ȷ�Ӧ��1molCO��ȫ��Ӧ�ų�������41KJ���Ȼ�ѧ����ʽΪ��CO��g��+H2O��g��=CO2��g��+H2��g����H=��41 kJ/mol��
���Դ��ǣ����ȣ�CO��g��+H2O��g��=CO2��g��+H2��g����H=��41 kJ/mol��