题目内容
下列说法中正确的是 ( )
| A.6.8 g固体KHSO4与3.9 g固体Na2O2中阴离子数目相同 |
| B.常温下铁、铜均不溶于浓硫酸, 说明常温下铁、铜与浓硫酸均不反应 |
| C.离子化合物中只含离子键 |
| D.中子数为18的氯原子可表示为18Cl |
A
解析试题分析:KHSO4=K++HSO4-。n(KHSO4)="0.05" mol.所以n(HSO4-)="0.05" mol; Na2O2=2Na++O22-.n(Na2O2)=" 0.05" mol,所以所以n(O22-)="0.05" mol;因此阴离子数目相同。正确。B.常温下铁不溶于浓硫酸,是因为Fe在常温下在浓硫酸中会被氧化产生一层致密的氧化物保护膜,阻止了反应的继续减小,而铜不溶于浓硫酸是因为没有达到铜与浓硫酸反应所需要的温度。原因不同。错误。C.离子化合物中一定含离子键,可能含有共价键。如NaOH含有离子键、减小共价键。错误。D.中子数为18的氯原子可表示为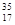 Cl.错误.
Cl.错误.
考点:考查物质的组成、结构、性质的知识。

练习册系列答案
相关题目
下列说法正确的是
| A.某粒子的电子数等于质子数,则该粒子可能是一种分子或一种离子 |
| B.构成单质的分子中一定含有共价键 |
| C.溶液和胶体的本质区别是有无丁达尔效应 |
| D.化学变化不产生新元素,产生新元素的变化不是化学变化 |
元素在周期表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是( )
| A.同一元素不可能既表现金属性,又表现非金属性 |
| B.第三周期主族元素的最高正化合价等于它所处的主族序数 |
| C.短周期元素形成离子后,最外层都达到8电子稳定结构 |
| D.同一主族的元素的原子,最外层电子数相同,化学性质完全相同 |
与氢氧根具有相同的质子数和电子数的微粒是
| A.CH4 | B.NH4+ | C.NH2- | D.Cl- |
已知X、Y、Z都是短周期元素,它们的原子序数依次增大,X原子的电子层数与它的核外电子总数相等,而Z原子的最外层电子数是次外层的3倍,Y和Z可以形成两种以上气态化合物,则下列说法错误的是( )
| A.Y和Z可以组成一种Y和Z的质量比为7∶8的化合物 |
| B.X、Y、Z可以组成一种盐 |
| C.X和Z可以组成原子个数比分别为1∶1和2∶1常温下呈液态的两种化合物 |
| D.由X、Y、Z三种元素中的任意两种组成的10电子微粒只有2种 |
甲、乙是周期表中同一主族的两种元素,若甲的原子序数为X,则乙的原子序数不可能为 ( )
| A.X+32 | B.X+4 | C.X+8 | D.X+18 |
下列各组顺序的排列错误的是
| A.半径:F—>Na+>Mg2+>Al3+ | B.沸点:H2O< H2S < H2Se |
| C.酸性:HClO4>H2SO4>H3PO4 | D.熔点:SiO2>NaCl>CO2 |
右表为元素周期表前四周期的一部分,下列有关W、X、Y、Z、R五种元素的叙述中,正确的是( )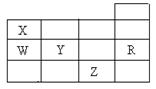
| A.常温下,Z单质为气态物质 |
| B.Y、Z的阴离子电子层结构都与R原子的相同 |
| C.W的氢化物的稳定性要比X的氢化物的稳定性强 |
| D.Y元素的非金属性比W元素的非金属性强 |
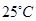 )。它们满足如图转化关系,则下列说法正确的是( )
)。它们满足如图转化关系,则下列说法正确的是( )