题目内容
20.2L密闭容器中,有下列反应体系:2NO(g)+O2(g)?2NO2(g).(1)将amolNO和bmolO2发生反应,要使反应达到平衡后反应物的物质的量和生成物的物质的量相等,则$\frac{a}{b}$的取值范围是c.
a.0<$\frac{a}{b}$<$\frac{2}{3}$ b.$\frac{2}{3}$<$\frac{a}{b}$<$\frac{1}{1}$ c.$\frac{2}{3}$<$\frac{a}{b}$<$\frac{4}{1}$ d.1<$\frac{a}{b}$<$\frac{5}{4}$
(2)某温度时,按物质的量比2:1充入NO和O2开始反应,n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(3)能说明该反应已达到平衡状态的是abc.
a.气体颜色不再变化 b.容器内压强保持不变
c.υ逆(NO)=2υ正(O2) d.容器内密度保持不变
(4)已知:K300℃>K350℃,能使该反应的反应速率增大,且平衡向正反应方向移动的是c.
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂.
分析 (1)假设转化的氧气为xmol,则:
2NO(g)+O2(g)?2NO2(g)
起始量(mol):a b 0
转化量(mol):2x x 2x
平衡量(mol):a-2x b-x 2x
则a-2x+b-x=2x,即a+b=5x,结合x<b及2x<a进行解答;
(2)化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比;
根据v=$\frac{△c}{△t}$计算0~1s内v(NO),再利用速率之比等于化学计量数之比计算0~1s内v(O2),根据v=$\frac{△c}{△t}$计算0~5s内v(NO),然后进行比较判断;
(3)可逆反应到达平衡时,同种物质的正逆速率相等,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化说明到达平衡;
(4)已知:K300℃>K350℃,说明升高温度平衡常数减小,平衡逆向移动,增大反应物浓度、使用催化剂均可以加快反应速率,增大反应物浓度,平衡正向移动,但使用催化剂不影响平衡移动,分离出生成物,使平衡正向移动,但反应速率会减慢.
解答 解:(1)假设转化的氧气为xmol,则:
2NO(g)+O2(g)?2NO2(g)
起始量(mol):a b 0
转化量(mol):2x x 2x
平衡量(mol):a-2x b-x 2x
则a-2x+b-x=2x,即a+b=5x,由于x<b,联立可得$\frac{a}{b}$<$\frac{4}{1}$,又由于2x<a,联立可得$\frac{a}{b}$>$\frac{2}{3}$,故$\frac{2}{3}$<$\frac{a}{b}$<$\frac{4}{1}$,
故选:c;
(2)2NO(g)+O2(g)?2NO2(g)的平衡常数表达式K=$\frac{{c}^{2}(N{O}_{2})}{{c}^{2}(NO)×c({O}_{2})}$;
0~1s内v(NO)=$\frac{\frac{(0.02-0.01)mol}{2L}}{1s}$=0.005mol/(L.s),速率之比等于化学计量数之比,则0~1s内v(O2)=$\frac{1}{2}$v(NO)=0.0025mol/(L.s),0~5s内v(NO)=$\frac{\frac{(0.02-0.007)mol}{2L}}{5s}$=0.0013mol/(L.s),故0~1s内以O2浓度变化表示的正反应速率大于0~5s内以NO浓度变化表示的正反应速率,
故答案为:$\frac{{c}^{2}(N{O}_{2})}{{c}^{2}(NO)×c({O}_{2})}$;大于;
(3)a.气体颜色不再变化,说明二氧化氮的浓度不变,反应到达平衡,故a正确;
b.随反应进行容器内混合气体物质的量不变,容器内压强发生变化,容器内压强保持不变,说明到达平衡,故b正确;
c.由于υ逆(NO)=2υ逆(O2),而υ逆(NO)=2υ正(O2),则υ逆(O2)=υ正(O2),反应到达平衡,故c正确;
d.混合气体总质量不变,容器容积不变,容器内密度始终保持不变,故d错误,
故选:abc;
(4)a.及时分离出NO2气体,平衡正向移动,但反应速率会减慢,故a错误;
b.适当升高温度,反应速率加快,由K300℃>K350℃,说明升高温度平衡常数减小,平衡逆向移动,故b错误;
c.增大O2的浓度,反应速率加快,平衡正向移动,故c正确;
d.选择高效催化剂,加快反应速率,但不影响平衡移动,故d错误,
故选:c.
点评 本题考查化学平衡计算与影响因素、反应速率计算、平衡状态判断等,(1)中注意充分利用可逆反应不能完全反应进行分析解答,难度中等.

 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案| A. | 在水溶液里或熔融状态下能够导电的化合物叫做电解质 | |
| B. | 电解质、非电解质都指化合物而言,单质不属于此范畴 | |
| C. | NH3的水溶液可以导电,所以NH3是电解质 | |
| D. | 纯水的导电性虽然很差,但是水是电解质 |
| A. | Fe(SCN)3溶液中加入固体KSCN后颜色变深 | |
| B. | 棕红色NO2加压后颜色先变深后变浅 | |
| C. | 打开碳酸型饮料的瓶盖,有大量的气体从饮料中冒出 | |
| D. | 用高压锅蒸煮食物更省时间 |
| A. | 强电解质的水溶液导电性要比弱电解质的水溶液导电性强 | |
| B. | SO2水溶液的导电性很好,所以 SO2是电解质 | |
| C. | 液态的铜导电性很好,所以铜是电解质 | |
| D. | 强电解质的水溶液中不存在溶质分子 |
| A. | 碳酸氢钠溶液与氢氧化钠溶液混合:HCO3-+OH-═H2O+CO32- | |
| B. | 稀 H2SO4与铁粉反应:2Fe+6H+=2Fe3++3H2↑ | |
| C. | 氢氧化钡溶液与稀 H2SO4反应:Ba2++SO42-=BaSO4↓ | |
| D. | 碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑ |

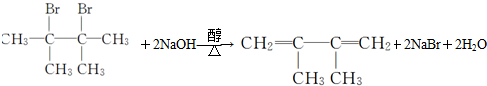 .
.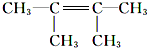 ;G的结构简式
;G的结构简式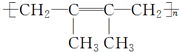 .F1和F2互为同分异构体.
.F1和F2互为同分异构体.