��Ŀ����
����Ŀ��ú��ֱ��ȼ�ջ�Դ������������Ⱦ���������γɵ�һ����Ҫԭ��ʵ��ú�������������ü�ޡ��Ҵ����״������صȾ���ú������ء�
������1����úת����ˮú������Ч�����Դ�����ʣ�
C(s)+H2O(g) ![]() CO(g)��H2(g) ��H��+131.3KJ/mol����Ӧ��ƽ�ⳣ������ʽΪK= ��
CO(g)��H2(g) ��H��+131.3KJ/mol����Ӧ��ƽ�ⳣ������ʽΪK= ��
��2��һ���¶��£�������ɱ��������Ͷ�뷴Ӧ����д˷�Ӧ��������˵����ȷ����
A����ϵ�м������(�����������ֲ���)��ƽ�ⲻ�ƶ�����Ӧ����H �����
B���������淴Ӧ��ֵ�㶨����˵��ƽ���ѽ���
C������ƽ���ѹ�������ƽ����Է�������������
D������ƽ���ѹ��ƽ�����淽���ƶ���ƽ�ⳣ����С
�����Ҵ�����Ҫ�Ļ�����Ʒ��Һ��ȼ�ϣ������������з�Ӧ��ȡ�Ҵ���
2CO2(g)+6H2(g) ![]() CH3CH2OH(g)+3H2O(g) ��H= a KJ/mol
CH3CH2OH(g)+3H2O(g) ��H= a KJ/mol
��һ��ѹǿ�£����������Ӧ��ʵ���������±���
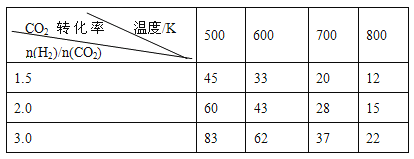
���ݱ������ݷ�����
��3��������Ӧ��a 0(����>����<������=��)
��4�����¶�ΪT1ʱ���÷�Ӧ��ƽ�ⳣ��K=1����2L�ܱ������м���һ������ϵ�����ʣ���Ӧ��ijʱ�̲�÷�Ӧ��ϵ�и������Ϊ1mol��
����ʱV(CO2)��= V(CO2)��(����>����<������=��)
������Ӧ�ں�ѹ���������н��У���ƽ���CO2�����ʵ���
A������1mol B������1mol C��С��1mol D����ȷ��
����CO2���Ǻϳ����ص���Ҫԭ�ϣ���CO2��NH3Ϊԭ�Ϻϳ�����[��ѧʽΪ[CO(NH2)2]����Ҫ��Ӧ���£���֪��
��2NH3(g)+CO2(g)=NH2CO2 NH4(s) ��H=+l59.5kJ��mol-1
��NH2CO2NH4(s)![]() CO(NH2)2(s)+H2O(g) ��H=+116.5kJ��mol-1
CO(NH2)2(s)+H2O(g) ��H=+116.5kJ��mol-1
��H2O(l)=H2O(g) ��H=+44.0kJ��mol-1
д��CO2��NH3�ϳ����غ�Һ̬ˮ���Ȼ�ѧ��Ӧ����ʽ
���𰸡�
��1��[C(CO).C(H2)]/C(H2O) ����2��BC��
��3��<����4����<����D��
����2NH3(g)+CO2(g)�TCO(NH2)2(s)+H2O(l)��H=��87.0 kJ��mol��1��
��������
���������������1������C(s)+H2O(g) ![]() CO(g)��H2(g) ��H��+131.3KJ/mol����Ӧ��ƽ�ⳣ������ʽΪK=[C(CO).C(H2)]/C(H2O)���ʴ�Ϊ��[C(CO).C(H2)]/C(H2O)��
CO(g)��H2(g) ��H��+131.3KJ/mol����Ӧ��ƽ�ⳣ������ʽΪK=[C(CO).C(H2)]/C(H2O)���ʴ�Ϊ��[C(CO).C(H2)]/C(H2O)��
��2��A��������Ӱ�췴Ӧ����H ������B���������淴Ӧ��ֵ�㶨����ʾ�����淴Ӧ������ȣ���˵��ƽ���ѽ�������ȷ��C������ƽ���ѹ��ƽ�������ƶ��������ƽ����Է���������![]() =15��18ת��������������ȷ��D������ƽ����¶Ȳ��䣬ƽ�ⳣ�����䣬����ѡBC��
=15��18ת��������������ȷ��D������ƽ����¶Ȳ��䣬ƽ�ⳣ�����䣬����ѡBC��
������3�����ݱ������ݿ�֪��������������ʱ�������¶ȣ�CO2��ת������С����ʾƽ�������ƶ���˵������Ӧ���ȣ�a��0���ʴ�Ϊ������
��4������Ӧ��ijʱ�̲�÷�Ӧ��ϵ�и������Ϊ1mol��Qc=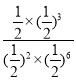 ��1=K��ƽ�������ƶ�����ʱV(CO2)����V(CO2)�����ʴ�Ϊ��<��������Ӧ�ں�ѹ���������н��У����ŷ�Ӧ�Ľ��У���Ӧ���¶����ͣ������¶ȣ�ƽ��������Ӧ�����ƶ���ƽ�ⳣ����������ƽ���CO2�����ʵ������ܴ��ڡ����ڻ�С��1mol����ѡD��
��1=K��ƽ�������ƶ�����ʱV(CO2)����V(CO2)�����ʴ�Ϊ��<��������Ӧ�ں�ѹ���������н��У����ŷ�Ӧ�Ľ��У���Ӧ���¶����ͣ������¶ȣ�ƽ��������Ӧ�����ƶ���ƽ�ⳣ����������ƽ���CO2�����ʵ������ܴ��ڡ����ڻ�С��1mol����ѡD��
������2NH3(g)+CO2(g)=NH2CO2 NH4(s)��H=+l59.5kJ��mol-1����NH2CO2NH4(s)![]() CO(NH2)2(s)+H2O(g) ��H=+116.5kJ��mol-1����H2O(l)=H2O(g)��H=+44.0kJ��mol-1�������Ȼ�ѧ����ʽ��˹���ɼ�����+��+���õ�CO2��NH3�ϳ����غ�Һ̬ˮ���Ȼ�ѧ��Ӧ����ʽΪ��2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l) ��H=-87.0KJ/mol���ʴ�Ϊ��2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)��H=-87.0KJ/mol
CO(NH2)2(s)+H2O(g) ��H=+116.5kJ��mol-1����H2O(l)=H2O(g)��H=+44.0kJ��mol-1�������Ȼ�ѧ����ʽ��˹���ɼ�����+��+���õ�CO2��NH3�ϳ����غ�Һ̬ˮ���Ȼ�ѧ��Ӧ����ʽΪ��2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l) ��H=-87.0KJ/mol���ʴ�Ϊ��2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)��H=-87.0KJ/mol