题目内容
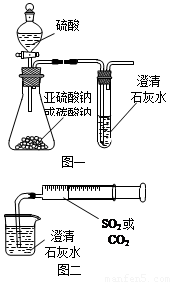
某同学用如图一所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2可以看到先浑浊后澄清的现象,但通入SO2没有看到浑浊现象。经过思考分析,该同学改用图二的装置,将气体收集在注射器中,缓慢地将气体一个气泡一个气泡地通入澄清石灰水中,结果都能看到石灰水先变浑浊再澄清的现象,且通入SO2产生的现象明显比通入CO2快。

(1)若锥形瓶内装的是亚硫酸钠,写出锥形瓶内反应的化学方程式:______________
______________________________。
(2)对比分析两组实验,你认为用图一装置实验时,通入SO2不能出现浑浊的原因可能是____________________________________。写出此时试管内发生反应的总化学方程式:____________________________________。
(3)用图二装置实验时,以相同速率通入CO2或SO2,SO2产生浑浊再变澄清的现象比CO2快,其原因是___________________________________________。
(4)用图一进行SO2与石灰水反应的实验时,为防止SO2污染空气,应用盛有过量浓烧碱溶液的容器吸收SO2,写出容器内发生反应的离子方程式:____________________。
(1)Na2SO3+H2SO4=Na2SO4+H2O+SO2(3分)
(2)反应时直接生成了酸式盐而看不到沉淀(3分)
Ca(OH)2+2SO2=Ca(HSO3)2(3分)
(3)SO2溶解度大,且对应的亚硫酸酸性比碳酸强,通入的SO2与石灰水反应快(3分)
(4)SO2+2OH-=SO32-+H2O(3分)
解析:CO2跟石灰水反应生成白色沉淀CaCO3,SO2跟石灰水反应生成白色沉淀CaSO3,当气体过量时白色沉淀又溶解,所以,一般认为不能用石灰水来区别CO2和SO2。然而本题给出的结论是:通入SO2没有看到浑浊现象。这要从CO2和SO2性质的区别上来分析原因,二者在水中的溶解度及对应酸的酸性不同。防止SO2污染空气,要增加尾气吸收装置,烧碱过量时生成的盐为Na2SO3。

 名校课堂系列答案
名校课堂系列答案(12分)某同学用如图一所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2可以看到先浑浊后澄清的现象,但通入SO2没有能看到浑浊现象。经过思考分析后,该同学改用图二的装置,将气体收集在注射器,缓慢地将气体一个气泡一个气泡地通入澄清石灰水中,都能看到石灰水先变浑浊再澄清的现象,且通入SO2产生现象明显比通入CO2快。

(1)对比分析两组实验,你认为用图一装置实验
时,通入SO2不能出现浑浊的原因可能是:
_________________。
(2)用图二装置实验时,以相同速率通入CO2或
SO2,SO2产生浑浊、澄清的现象比CO2
快的原因是______________________________________。
(3)用图一进行SO2与石灰水反应的实验时,从安全角度
考虑装置应做何改进?
_____________________________________________。
(4)有人提出上述实验现象“石灰水先变浑浊再澄清”可能与澄清石灰水的浓度有关。为了探究CO2通入澄清石灰水中的实验现象,查得下列数据:
Ⅰ 20℃时,Ca(OH)2 的溶解度为:0.165g/100g水。
Ⅱ 不同浓度石灰水生成CaCO3的最大量
| 饱和石灰水与水的体积比 | 1:0 | 1:1 | 1:2 | 1:3 | 1:5 | 1:7 |
| 能生成CaCO3的最大量(g/100水) | A | 0.110 | 0.073 | 0.055 | 0.037 | 0.028 |
① 上表中A= g/100g水
Ⅲ 在1.01×105Pa CO2压力下,CaCO3的溶解度
| 热力学温度/K | 282 | 298 | 308 |
| CaCO3溶解度(g/100水) | 0.130 | 0.094 | 0.076 5 |
Ⅳ 在不同压强(CO2)下,CaCO3溶解度(18℃)
| P(CO2)/Pa | 0 | 1.40×104 | 9.95×104 |
| CaCO3溶解度(g/100水) | 0.001 3 | 0.023 3 | 0.108 6 |
认真分析以上数据回答下列问题:
②由表Ⅲ和表Ⅳ可知CaCO3溶解度的变化规律是:
③由以上数据可以得出结论:欲观察到“石灰水先变浑浊再澄清的现象”,所需要的实验条件是:
(12分)某同学用如图一所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2可以看到先浑浊后澄清的现象,但通入SO2没有能看到浑浊现象。经过思考分析后,该同学改用图二的装置,将气体收集在注射器,缓慢地将气体一个气泡一个气泡地通入澄清石灰水中,都能看到石灰水先变浑浊再澄清的现象,且通入SO2产生现象明显比通入CO2快。
(1)对比分析两组实验,你认为用图一装置实验
时,通入SO2不能出现浑浊的原因可能是:
_________________。
(2)用图二装置实验时,以相同速率通入CO2或
SO2,SO2产生浑浊、澄清的现象比CO2
快的原因是______________________________________。
(3)用图一进行SO2与石灰水反应的实验时,从安全角度
考虑装置应做何改进?
_____________________________________________。
(4)有人提出上述实验现象“石灰水先变浑浊再澄清”可能与澄清石灰水的浓度有关。为了探究CO2通入澄清石灰水中的实验现象,查得下列数据:
Ⅰ 20℃时,Ca(OH)2 的溶解度为:0.165g/100g水。
Ⅱ 不同浓度石灰水生成CaCO3的最大量
|
饱和石灰水与水的体积比 |
1:0 |
1:1 |
1:2 |
1:3 |
1:5 |
1:7 |
|
能生成CaCO3的最大量(g/100水) |
A |
0.110 |
0.073[来源:Zxxk.Com] |
0.055 |
0.037 |
0.028 |
① 上表中A= g/100g水
Ⅲ 在1.01×105Pa CO2压力下,CaCO3的溶解度
|
热力学温度/K |
282 |
298 |
308 |
|
CaCO3溶解度(g/100水)[来源:学#科#网Z#X#X#K] |
0.130 |
0.094 |
0.076 5 |
Ⅳ 在不同压强(CO2)下,CaCO3溶解度(18℃)
|
P(CO2)/Pa |
0 |
1.40×104 |
9.95×104 |
|
CaCO3溶解度(g/100水) |
0.001 3 |
0.023 3 |
0.108 6 |
认真分析以上数据回答下列问题:
②由表Ⅲ和表Ⅳ可知CaCO3溶解度的变化规律是:
③由以上数据可以得出结论:欲观察到“石灰水先变浑浊再澄清的现象”,所需要的实验条件是:
 (分)某同学用如图一所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2可以看到先浑浊后澄清的现象,但通入SO2看不到浑浊现象。经思考后该同学改用图二的装置,将气体收集在注射器,缓慢地将气体一个气泡一个气泡地通入澄清石灰水中,都能看到石灰水先变浑浊再澄清的现象,且通入SO2时产生现象明显比通入CO2快。
(分)某同学用如图一所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2可以看到先浑浊后澄清的现象,但通入SO2看不到浑浊现象。经思考后该同学改用图二的装置,将气体收集在注射器,缓慢地将气体一个气泡一个气泡地通入澄清石灰水中,都能看到石灰水先变浑浊再澄清的现象,且通入SO2时产生现象明显比通入CO2快。