��Ŀ����
����Ŀ����ͼ��ʾװ���У��ס��ҡ��������ձ����ηֱ�ʢ��100 g 5.00%��NaOH��Һ��������CuSO4��Һ��100 g 10.00%��K2SO4��Һ���缫��Ϊʯī�缫��
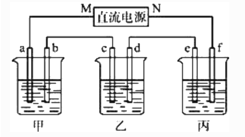
��ͨ��Դ������һ��ʱ���ñ���K2SO4������������Ϊ10.47%������c�缫�������ӡ�
�ٵ�Դ��N��Ϊ________����
�ڵ缫b�Ϸ����ĵ缫��ӦʽΪ___________________________________________��
�۵缫b�����ɵ������ڱ�״���µ����___________L��
�ܵ缫c�������仯��________g��
�ݵ��ǰ����Һ��pH���ֲ������________��
A������Һ B������Һ C������Һ
���𰸡� �� 4OH��-4e��=2H2O��O2�� 2.8 16 C
����������1��c�缫������������Ϊͭ���ӵõ������ɵ���ͭ�������ڵ缫���棬����c�缫һ��Ϊ�����������Ӷ��Ʋ����MΪ������NΪ������
��2��bΪ�������������Һ������������Ӧ����������ʧ����������������4OH��-4e��=2H2O��O2��
��3�����е��K2SO4����Һʵ���൱�ڵ��ˮ��ˮ����ʹ��Һ������������10%���ߵ�10.47%��ԭ����100 g 10.00%��K2SO4��Һ�к��������10g����Ӧ����Һ����Ϊ10��10.47% = 95.51g�����Լ��ٵ�ˮΪ100-95.51=4.49g������Ӧ��ˮԼΪ0.25mol�����ݵ��ˮ�ķ�Ӧ��ת�Ƶ���Ϊ0.5mol������ÿ���缫��ת�Ƶĵ��Ӷ���0.5mol������b�缫�ķ�Ӧ����ʽ���ɼ�������ɵ�����Ϊ0.125mol���Ϊ2.8L��
��4��c�缫�ķ�Ӧ��Cu2+ + 2e- = Cu��ת��0.5mol���ӣ�����0.25molCu����Ϊ16g��
��5����Ϊ����������Һ�����ʱ�൱�ڵ��ˮ������ˮ�ļ��٣���������Ũ�����ӣ�pH������Ϊ����ͭ��Һ�����ķ�ӦΪ2CuSO4 + 2H2O![]() 2Cu + O2��+ 2H2SO4��������Һ��pH��С����Ϊ�������Һ�����������൱�ڵ��ˮ�����Dz���Ũ����α仯��������վ������Եģ�pH=7�����ֲ��䡣��Ϊ����
2Cu + O2��+ 2H2SO4��������Һ��pH��С����Ϊ�������Һ�����������൱�ڵ��ˮ�����Dz���Ũ����α仯��������վ������Եģ�pH=7�����ֲ��䡣��Ϊ����

 ��ս�п�����ϵ�д�
��ս�п�����ϵ�д�