题目内容
在密闭容器中,由一定起始浓度的氙(Xe)和F2反应,可得到三种氟化物。各种生成物在平衡体系内的分压与反应温度的关系如图1-2-10所示(已知气体的分压之比等于物质的量之比)。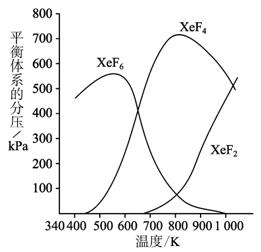
图1-2-10
(1)420 K时,发生反应的化学方程式为__________________;若反应中消耗1 mol Xe,则转移电子__________mol。
(2)600—800 K时,会发生反应:XeF6(g)![]() XeF4(g)+F2(g),其反应热ΔH_______0(填“>”“<”或“=”=。理由是_________________________。
XeF4(g)+F2(g),其反应热ΔH_______0(填“>”“<”或“=”=。理由是_________________________。
(3)900 K时,容器中存在的组分有______________________。
解析:本题以数形结合的形式,主要考查化学反应速率、化学平衡等知识,还涉及氧化还原反应中电子转移数目的计算、反应热ΔH的判定等。题目以看图设置情景设问,重点考查观察能力和思维能力。
(1)由图象可知,在420 K时,平衡体系中无XeF4、XeF2生成(二者分压为零),只有生成物XeF6,此时反应的化学方程式为![]() 。若反应中消耗1 mol Xe时,则转移电子6 mol。
。若反应中消耗1 mol Xe时,则转移电子6 mol。
(2)在600—800 K时,反应XeF6(g)![]() XeF4(g)+F2(g)达平衡后,随着温度的升高,XeF6不断减少,XeF4不断增多,上述平衡向右移动,说明正反应为吸热反应,该反应的ΔH>0。
XeF4(g)+F2(g)达平衡后,随着温度的升高,XeF6不断减少,XeF4不断增多,上述平衡向右移动,说明正反应为吸热反应,该反应的ΔH>0。
(3)由图象可知,在900 K时,平衡体系中三种生成物XeF6、XeF4、XeF2都存在,又因为是可逆反应,还应有反应物Xe、F2存在。
答案:(1)Xe+3F2![]() XeF6 6
XeF6 6
(2)> 随着温度的升高,XeF6(g)![]() XeF4(g)+F2(g)平衡向右移动,根据温度升高,平衡向吸热反应方向移动的原理,则该反应的ΔH>0
XeF4(g)+F2(g)平衡向右移动,根据温度升高,平衡向吸热反应方向移动的原理,则该反应的ΔH>0
(3)XeF6、XeF4、XeF2、Xe、F2

练习册系列答案
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案
相关题目
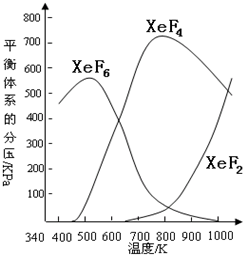 在密闭容器中,由一定起始浓度的氙(Xe)和F2反应,可得到3种氟化物.各种生成物在平衡体系内的分压与反应温度的关系如图所示(己知气体的分压之比等于物质的量之比).
在密闭容器中,由一定起始浓度的氙(Xe)和F2反应,可得到3种氟化物.各种生成物在平衡体系内的分压与反应温度的关系如图所示(己知气体的分压之比等于物质的量之比).

