题目内容
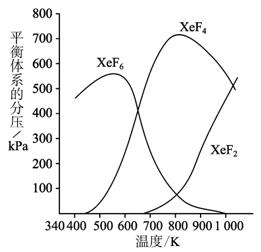
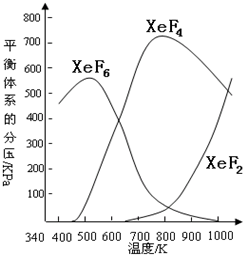 在密闭容器中,由一定起始浓度的氙(Xe)和F2反应,可得到3种氟化物.各种生成物在平衡体系内的分压与反应温度的关系如图所示(己知气体的分压之比等于物质的量之比).
在密闭容器中,由一定起始浓度的氙(Xe)和F2反应,可得到3种氟化物.各种生成物在平衡体系内的分压与反应温度的关系如图所示(己知气体的分压之比等于物质的量之比).(1)420K时,发生反应的化学方程式为:
Xe+3F2=XeF6
Xe+3F2=XeF6
;若反应中消耗1 mol Xe,则转移电子6
6
mol.(2)600~800K时,会发生反应:XeF6(g)?XeF4(g)+F2(g),
其反应热△H
>
>
0(填“>”“=”或“<”).理由是随着温度的升高,XeF6(g)?XeF4(g)+F2(g)平衡向右移动,根据温度升高平衡向吸热反应方向移动的原理,则该反应的△H>0
随着温度的升高,XeF6(g)?XeF4(g)+F2(g)平衡向右移动,根据温度升高平衡向吸热反应方向移动的原理,则该反应的△H>0
.(3)900K时,容器中存在的组分有
XeF6、XeF4、XeF2、Xe、F2
XeF6、XeF4、XeF2、Xe、F2
.分析:(1)通过对图中给出的图象分析可知,在420K时,产物只有XeF6;
(2)在600K~800K时随着温度的升高,XeF6的分压减小,XeF4的分压增大,即平衡正向移动根据温度对平衡移动的影响分析;
(3)在900K时XeF2、XeF4、XeF6共存,根据可逆反应的特点,还应有XeF2存在着.
(2)在600K~800K时随着温度的升高,XeF6的分压减小,XeF4的分压增大,即平衡正向移动根据温度对平衡移动的影响分析;
(3)在900K时XeF2、XeF4、XeF6共存,根据可逆反应的特点,还应有XeF2存在着.
解答:解:(1)在420K时,产物只有XeF6,故其反应方程式为:Xe+3F2=XeF6,XeF6中Xe的化合价为+6价,则反应中消耗l mol Xe,则转移电子6mol,
故答案为:Xe+3F2=XeF6;6;
(2)在600K~800K时随着温度的升高,XeF6的分压减小,XeF4的分压增大,即平衡正向移动,故正向为吸热反应,△H>0,
故答案为:>;随着温度的升高,XeF6(g) XeF4(g)+F2(g)平衡向右移动,根据温度升高平衡向吸热反应方向移动的原理,则该反应的△H>0;
XeF4(g)+F2(g)平衡向右移动,根据温度升高平衡向吸热反应方向移动的原理,则该反应的△H>0;
(3)在900K时XeF2、XeF4、XeF6共存,根据可逆反应的特点,还应有XeF2存在着,
故答案为:XeF6、XeF4、XeF2、Xe、F2.
故答案为:Xe+3F2=XeF6;6;
(2)在600K~800K时随着温度的升高,XeF6的分压减小,XeF4的分压增大,即平衡正向移动,故正向为吸热反应,△H>0,
故答案为:>;随着温度的升高,XeF6(g)
 XeF4(g)+F2(g)平衡向右移动,根据温度升高平衡向吸热反应方向移动的原理,则该反应的△H>0;
XeF4(g)+F2(g)平衡向右移动,根据温度升高平衡向吸热反应方向移动的原理,则该反应的△H>0;(3)在900K时XeF2、XeF4、XeF6共存,根据可逆反应的特点,还应有XeF2存在着,
故答案为:XeF6、XeF4、XeF2、Xe、F2.
点评:本题是一道综合性图象题,科学准确地分析图形,如理解顶点、拐点的意义,理解曲线的变化趋势,将图象中的信息与化学反应原理进行关联,进而得出解题的思维方法.即由“形”到“化学反应原理”再到具体的解题方法与过程,是考生思维能力的跨越式发展.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目