题目内容
将5.1g镁和铝投入500mL 2mol/L的盐酸中,生成氢气0.5g,金属完全溶解;再加入4mol/L的NaOH溶液,生成沉淀的质量最多是( )
| A、22.1g | B、8.5g |
| C、10.2g | D、13.6g |
考点:铝的化学性质,镁的化学性质
专题:计算题,元素及其化合物
分析:发生的反应为:Mg+2HCl=MgCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑,氯化镁和氯化铝,分别与NaOH溶液反应的方程式为:AlCl3+3NaOH=Al(OH)3↓+3NaCl,MgCl2 +2NaOH=Mg(OH)2↓+2NaCl.Mg2+和Al3+全部转化为沉淀,此时生成沉淀最多,以此来解答.
解答:
解:镁铝合金与盐酸反应,金属完全溶解,发生的反应为:Mg+2HCl=MgCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑,设Mg、Al的物质的量分别为x、y,
则
解得x=y=0.1mol,
氯化镁和氯化铝分别与NaOH溶液反应的方程式为:AlCl3+3NaOH=Al(OH)3↓+3NaCl,MgCl2 +2NaOH=Mg(OH)2↓+2NaCl,Mg2+和Al3+全部转化为沉淀,此时生成沉淀最多,
沉淀的质量为0.1mol×78g/mol+0.1mol×5.8g/mol=13.6g,
故选D
则
|
解得x=y=0.1mol,
氯化镁和氯化铝分别与NaOH溶液反应的方程式为:AlCl3+3NaOH=Al(OH)3↓+3NaCl,MgCl2 +2NaOH=Mg(OH)2↓+2NaCl,Mg2+和Al3+全部转化为沉淀,此时生成沉淀最多,
沉淀的质量为0.1mol×78g/mol+0.1mol×5.8g/mol=13.6g,
故选D
点评:本题考查Al的化学性质及反应的计算,为高频考点,把握发生的反应及沉淀的质量为氢氧化镁和氢氧化铝之和为解答的关键,侧重分析与计算能力的考查,题目难度中等.

练习册系列答案
相关题目
肼(N2H4)-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液.下列说法中,不正确的是( )


| A、该电池放电时,通入肼的一极为负极 |
| B、电池每释放1mol N2转移的电子数为4NA |
| C、通入空气的一极的电极反应式是:O2+2H2O+4e-=4OH- |
| D、电池工作一段时间后,电解质溶液的pH将不变 |
单质与浓硝酸混合,出现的情况依次为:①反应生成相应的硝酸盐;②反应生成最高价含氧酸;③常温下单质发生钝化;④不发生反应.符合上述要求的单质组是( )
| A、Cu、C、Zn、Au |
| B、Si、P、Al、Pt |
| C、Fe、C、Pt、Hg |
| D、Cu、S、Fe、Au |
下列各组含氧酸中,酸性依次增强的是( )
| A、H2CO3、H4SiO4、H3PO4 |
| B、HNO3、H3PO4、H2SO4 |
| C、H3PO4、H2SO4、HClO4 |
| D、HClO4、H2SO4、H2CO3 |
塑化剂是一种对人体有害的物质.增塑剂DCHP可由邻苯二甲酸酐与环己醇反应制得:下列说法正确的是( )


| A、环己醇分子中所有的原子可能共平面 |
| B、1mol DCHP可与含4mol NaOH的溶液完全反应 |
| C、DCHP能发生加成、取代反应,不能发生消去反应 |
| D、DCHP易溶于水 |
下列关于胶体的性质叙述正确的是( )
| A、只带正电荷 |
| B、能产生丁达尔效应 |
| C、相当稳定 |
| D、都是透明的 |
下列各项叙述中,正确的是( )
| A、C6H5CH2CH2OH与C6H5OH互为同系物 |
| B、H2O与D2O互为同素异形体 |
C、 与 与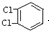 互为同分异构体 互为同分异构体 |
| D、等物质的量的乙醇和乙烯完全燃烧时所需氧气的质量相等 |
下列关于离子键的说法中,正确的是( )
| A、阴阳离子间相互吸引即离子键 |
| B、非金属元素所组成的化合物中不可能有离子键 |
| C、一个阳离子只可与一个阴离子之间存在离子键 |
| D、活泼金属与非金属化合时一般形成离子键 |
实验室常用MnO2与浓盐酸共热制取Cl2,也可用KClO3、KMnO4、K2Cr2O7代替MnO2与浓盐酸反应制Cl2.若制取等量的Cl2,转移电子数最少的是( )
| A、KClO3和浓盐酸反应 |
| B、MnO2和浓盐酸反应 |
| C、KMnO4和浓盐酸反应 |
| D、K2Cr2O7和浓盐酸反应 |