题目内容
(1)0.3mol NH3 分子中所含质子数与______个H2O分子中所含质子数相等.
(2)含0.4mol Al3+的Al2(SO4)3中所含的SO42-的物质的量是______.
(3)已知16g A和20g B 恰好完全反应生成0.04mol C 和31.76g D,则C的摩尔质量为______.
解:(1)1个NH3和1个H2O分子含有的质子数相等,
则有:n(H2O)=n(NH3)=0.3mol,
N(H2O)=0.3×6.02×1023个=1.806×1023个,
故答案为:1.806×1023;
(2)n(SO42-)=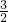 n(Al3+)=
n(Al3+)=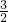 ×0.4mol=0.6mol,故答案为:0.6mol;
×0.4mol=0.6mol,故答案为:0.6mol;
(3)化学反应遵循质量守恒定律,则
16g+20g=m(C)+31.76g,
m(C)=4.24g,
M(C)=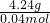 =106g/mol,
=106g/mol,
故答案为:106g/mol.
分析:(1)根据N=nNA结合分子的组成计算;
(2)根据n=cV结合离子之间的物质的量关系计算;
(3)根据质量守恒定律计算.
点评:本题考查物质的量的相关计算,题目难度不大,注意把握相关物理量的计算公式的运用.
则有:n(H2O)=n(NH3)=0.3mol,
N(H2O)=0.3×6.02×1023个=1.806×1023个,
故答案为:1.806×1023;
(2)n(SO42-)=
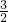 n(Al3+)=
n(Al3+)=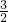 ×0.4mol=0.6mol,故答案为:0.6mol;
×0.4mol=0.6mol,故答案为:0.6mol;(3)化学反应遵循质量守恒定律,则
16g+20g=m(C)+31.76g,
m(C)=4.24g,
M(C)=
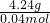 =106g/mol,
=106g/mol,故答案为:106g/mol.
分析:(1)根据N=nNA结合分子的组成计算;
(2)根据n=cV结合离子之间的物质的量关系计算;
(3)根据质量守恒定律计算.
点评:本题考查物质的量的相关计算,题目难度不大,注意把握相关物理量的计算公式的运用.

练习册系列答案
相关题目
(双选).在密闭容器中进行反应X2(g)+Y2(g)?2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol.L-1、0.3mol.L-1、0.2mol.L-1,在一定条件下当反应达到平衡时,各物质的浓度有可能是( )
| A、Z为0.3mol.L-1, | B、X2为0.2mol.L-1, | C、Y2为0.3mol.L-1, | D、Z为0.4mol.L-1, |