题目内容
向1.00L 0.3mol?L-1NaOH溶液中缓慢通入CO2气体至溶液增重8.8g.有关该溶液说法正确的是( )
分析:向1L 0.3mol/L的NaOH溶液中缓缓通入CO2气体至溶液增重8.8g,则增重的8.8g为二氧化碳的质量,物质的量为0.2mol,发生反应CO2+NaOH=NaHCO3,CO2+2NaOH=Na2CO3+H2O,由于n(CO2):n(NaOH)=2:3=1:1.5,介于1:1~1:2之间,所以两个反应都发生,所得溶液中溶质为Na2CO3和NaHCO3,结合物料守恒与电荷守恒判断.
解答:解:向1L 0.3mol/L的NaOH溶液中缓缓通入CO2气体至溶液增重8.8g,则增重的8.8g为二氧化碳的质量,物质的量为0.2mol,发生反应CO2+NaOH=NaHCO3,CO2+2NaOH=Na2CO3+H2O,由于n(CO2):n(NaOH)=2:3=1:1.5,介于1:1~1:2之间,所以两个反应都发生,所得溶液中溶质为Na2CO3和NaHCO3,
A.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),故A正确;
B.由碳元素守恒可知c(HCO3-)+c(CO32-)+c(H2CO3)=0.2mol/L,溶液中c(Na+)=0.3mol/L,所以
c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3),故B错误;
C.碳酸根离子、碳酸氢根离子都水解,而钠离子不水解,所以其混合溶液呈碱性,则c(OH-)>c(H+),故C错误;
D.通过以上分析知,溶质是碳酸氢钠和碳酸钠,故D错误;
故选A.
A.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),故A正确;
B.由碳元素守恒可知c(HCO3-)+c(CO32-)+c(H2CO3)=0.2mol/L,溶液中c(Na+)=0.3mol/L,所以
| 2 |
| 3 |
C.碳酸根离子、碳酸氢根离子都水解,而钠离子不水解,所以其混合溶液呈碱性,则c(OH-)>c(H+),故C错误;
D.通过以上分析知,溶质是碳酸氢钠和碳酸钠,故D错误;
故选A.
点评:本题考查根据方程式计算、离子浓度的比较,难度中等,判断二氧化碳与氢氧化钠的反应是解题关键,注意选项中离子浓度比较中物料守恒、电荷守恒的运用.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
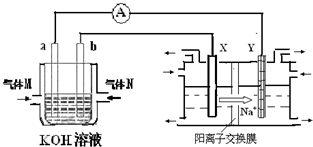 化学在能源开发与利用中起到十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.
化学在能源开发与利用中起到十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.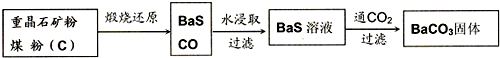
 HS-+OH-
HS-+OH-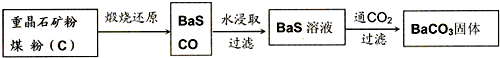

 O2(g)=CO(g);△H=-110.5kJ?mol-1
O2(g)=CO(g);△H=-110.5kJ?mol-1