题目内容
【题目】丙烯是重要的有机化工原料,主要用于生产聚丙烯、丙烯腈、环氧丙烷等。
(1)以丁烯和乙烯为原料制备丙烯的方法被称为“烯烃歧化法",主要反应为C4H8(g)+C2H4(g) ![]() 2C3H6(g)
2C3H6(g)
已知相关燃烧热数据:
C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) △H1=-1411kJ·mol-1
C3H6(g)+ ![]() O2(g)=3CO2(g)+3H2O(l) △H2=-2049kJ·mol-1
O2(g)=3CO2(g)+3H2O(l) △H2=-2049kJ·mol-1
C4H8(g)+6O2(g)=4CO2(g)+4H2O(l) △H3=-2539kJ·mol-1
①乙烯的电子式为。
②相同质量的C2H4(g)、C3H6(g)和C4H8(g)充分燃烧,放出的热量由多到少的顺序依次为(填写化学式)。
③ 上述“烯烃歧化法”的反应的热化学方程式为。
(2)“丁烯裂解法”是另一种重要的丙烯生产法,生产过程中会有生成乙烯的副反应发生。
反应如下:主反应:3C4H8 ![]() 4C3H6;副反应:C4H8
4C3H6;副反应:C4H8 ![]() 2C2H4
2C2H4
测得上述两反应的平衡体系中,各组分的质量分数(w%)随温度(T)和压强(p)变化的趋势分别如图1和图2所示: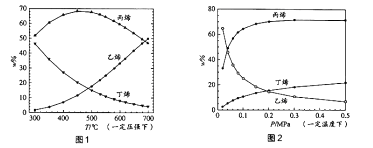
①平衡体系中的丙烯和乙烯的质量比[ ![]() ]是工业生产丙烯时选择反应条件的重要指标之一,从产物的纯度考虑,该数值越高越好,从图1和图2中表现的趋势来看,下列反应条件最适宜的是(填字母序号)
]是工业生产丙烯时选择反应条件的重要指标之一,从产物的纯度考虑,该数值越高越好,从图1和图2中表现的趋势来看,下列反应条件最适宜的是(填字母序号)
A. 300℃ 0.1MPa B. 700℃ 0.1MPa
C.300℃ 0.5MPa D.700℃ 0.5MPa
②有研究者结合图1数据并综合考虑各种因素,认为450℃的反应温度比300℃或700℃更合适,从反应原理角度分析其理由可能是。
③图2中,随压强增大,平衡体系中丙烯的质量分数呈上升趋势,从平衡角度解释其原因是。
【答案】
(1)![]() ,C2H4>C3H6>C4H8,C4H8(g)+C2H4(g)=2C3H6(g)△H=+148kJ·mol-1
,C2H4>C3H6>C4H8,C4H8(g)+C2H4(g)=2C3H6(g)△H=+148kJ·mol-1
(2)C,450℃比300℃的反应速率快;比700℃的副反应程度小;丁烯转化成丙烯的转化率高;该温度下催化剂的选择性最高;该温度是催化剂的活性温度,压强增大,生成乙烯的副反应平衡逆向移边,丁烯浓度增大,导致主反应的平衡正向移动,丙烯含量增大。
【解析】解:(1)①乙烯分子中含有碳碳双键,电子式为 ![]() 。
。
所以答案是: ![]() ;
;
②根据方程式,相同质量的C2H4(g)、C3H6(g)和C4H8(g)充分燃烧,假设质量均为1g,放出的热量分别为 ![]() =50.39kJ,
=50.39kJ, ![]() =48.78kJ,
=48.78kJ, ![]() =45.33kJ,放出的热量由多到少的顺序为C2H4>C3H6>C4H8。
=45.33kJ,放出的热量由多到少的顺序为C2H4>C3H6>C4H8。
所以答案是:C2H4>C3H6>C4H8;
③ i.C2H4(g)+3O2(g)=2CO2(g)+2H2O(l)△H1=-1411kJ·mol-1,ii.C3H6(g)+ ![]() O2(g)=3CO2(g)+3H2O(l)△H2=-2049kJ·mol-1,iii.C4H8(g)+6O2(g)=4CO2(g)+4H2O(l)△H3=-2539kJ·mol-1,根据盖斯定律,将i+iii-ii×2得:C2H8(g)+C2H4(g)
O2(g)=3CO2(g)+3H2O(l)△H2=-2049kJ·mol-1,iii.C4H8(g)+6O2(g)=4CO2(g)+4H2O(l)△H3=-2539kJ·mol-1,根据盖斯定律,将i+iii-ii×2得:C2H8(g)+C2H4(g) ![]() 2C3H6(g) △H=(-1411)+(-2539)-(-2049)×2=+148kJ·mol-1。
2C3H6(g) △H=(-1411)+(-2539)-(-2049)×2=+148kJ·mol-1。
所以答案是:C4H8(g)+C2H4(g)=2C3H6(g)△H=+148kJ·mol-1;
(2)①根据图像1,在温度为300℃是丙烯的含量很高,乙烯的含量很小,即 ![]() 比值较大;根据图像2,压强在0.5MPa时丙烯的含量很高,乙烯的含量很小,即
比值较大;根据图像2,压强在0.5MPa时丙烯的含量很高,乙烯的含量很小,即 ![]() 比值较大;因此最适宜的条件为:300℃,0.5MPa。
比值较大;因此最适宜的条件为:300℃,0.5MPa。
所以答案是:C;
②450℃的反应温度比300℃或700℃更合适的可能的原因有:450℃比300℃的反应速率快;比700℃的副反应程度小;丁烯转化成丙烯的转化率高;该温度下催化剂的选择性最高。
所以答案是:450℃比300℃的反应速率快;比700℃的副反应程度小;丁烯转化成丙烯的转化率高;该温度下催化剂的选择性最高;该温度是催化剂的活性温度等;
③根据主反应:3C4H8 ![]() 4C3H6;副反应:C4H8
4C3H6;副反应:C4H8 ![]() 2C2H4可知,压强增大,生成乙烯的副反应平衡逆向移边,导致丁烯浓度增大,使得主反应的平衡正向移动,丙烯含量增大。
2C2H4可知,压强增大,生成乙烯的副反应平衡逆向移边,导致丁烯浓度增大,使得主反应的平衡正向移动,丙烯含量增大。
所以答案是:压强增大,生成乙烯的副反应平衡逆向移边,丁烯浓度增大,导致主反应的平衡正向移动,丙烯含量增大。
【考点精析】通过灵活运用烯烃,掌握分子中含有碳碳双键的一类链烃叫做烯烃,单烯烃通式为CnH2n(n≥2)即可以解答此题.