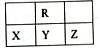
题目内容
(12分)有A、B、C、D、E、F六种前四周期的元素,原子序数依次增大,A、B、C、D、E均为短周期元素,D和F元素对应的单质为日常生活中常见金属。A原子核内只有一个质子,元素A与B形成的气态化合物甲具有10e-、空间构型为三角锥形,C元素原子的最外层电子数是其电子层数的3倍,C与E同主族。下图中均含D或F元素的物质均会有图示转化关系:

①均含D元素的乙、丙、丁微粒间的转化全为非氧化还原反应;
②均含F元素的乙(单质)、丙、丁微粒间的转化全为氧化还原反应。请回答下列问题:
(1)化合物甲的电子式为 。
(2)F元素在周期表中的位置 ;稳定性:A2C A2E(填“大于”“小于” “等于”)。
(3)均含有D元素的乙与丁在溶液中发生反应的离子方程式 。
(4)丙、丁分别是含F元素的简单阳离子,检验含丙、丁两种离子的混合溶液中的低价离子,可以用酸性KMnO4溶液,其对应的离子方程式为:
(5)已知常温下化合物FE的Ksp=6×10-18 mol2·L-2,常温下将1.0×10-5mol·L-1的Na2E溶液与含FSO4溶液按体积比3 :2混合,若有沉淀F E生成,则所需的FSO4的浓度要求 。(忽略混合后溶液的体积变化)。

①均含D元素的乙、丙、丁微粒间的转化全为非氧化还原反应;
②均含F元素的乙(单质)、丙、丁微粒间的转化全为氧化还原反应。请回答下列问题:
(1)化合物甲的电子式为 。
(2)F元素在周期表中的位置 ;稳定性:A2C A2E(填“大于”“小于” “等于”)。
(3)均含有D元素的乙与丁在溶液中发生反应的离子方程式 。
(4)丙、丁分别是含F元素的简单阳离子,检验含丙、丁两种离子的混合溶液中的低价离子,可以用酸性KMnO4溶液,其对应的离子方程式为:
(5)已知常温下化合物FE的Ksp=6×10-18 mol2·L-2,常温下将1.0×10-5mol·L-1的Na2E溶液与含FSO4溶液按体积比3 :2混合,若有沉淀F E生成,则所需的FSO4的浓度要求 。(忽略混合后溶液的体积变化)。
(12分,每空2分) (1)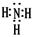 (2分) (2)第四周期第Ⅷ族(2分) 大于(2分)
(2分) (2)第四周期第Ⅷ族(2分) 大于(2分)
(3)Al3++ 3AlO2-+6H2O=4Al(OH)3↓(2分) (4)5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O(2分)
(5)≥2.5×10-12 mol/L(2分)(未写“≥”给1分,未写单位和其它答案不给分)
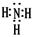 (2分) (2)第四周期第Ⅷ族(2分) 大于(2分)
(2分) (2)第四周期第Ⅷ族(2分) 大于(2分)(3)Al3++ 3AlO2-+6H2O=4Al(OH)3↓(2分) (4)5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O(2分)
(5)≥2.5×10-12 mol/L(2分)(未写“≥”给1分,未写单位和其它答案不给分)
试题分析:A原子核内只有一个质子,因此A是氢元素。元素A与B形成的气态化合物甲具有10e-、空间构型为三角锥形,所以甲是氨气,B是氮元素。C元素原子的最外层电子数是其电子层数的3倍,且C的原子序数大于氮元素的,所以C是氧元素。C与E同主族,则E是S元素。D和F元素对应的单质为日常生活中常见金属,所以根据原子序数大小关系可知D是Al,F是Fe。
(1)氨气是含有共价键的共价化合物,其电子式是
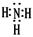 。
。(2)铁的原子序数是26,位于元素周期表的第四周期第Ⅷ族;同主族自上而下,非金属性逐渐减弱,因此氧元素的非金属性强于S元素的非金属性。非金属性越强,氢化物的稳定性越强,因此H2O的稳定性强于H2S的稳定性。
(3)均含有Al元素的乙与丁在溶液中反应生成丙,因此丙是氢氧化铝,所以发生反应的离子方程式是Al3++ 3AlO2-+6H2O=4Al(OH)3↓。
(4)Fe2+具有还原性,能被酸性KMnO4溶液氧化,相应的离子方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O。
(5)设所需的FeSO4的浓度是x。常温下将1.0×10-5mol·L-1的Na2S溶液与含FeSO4溶液按体积比3 :2混合后S2-的浓度是1.0×10-5mol/L×
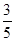 =6×10-6mol/L,Fe2+浓度是
=6×10-6mol/L,Fe2+浓度是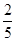 x,所以要有FeS沉淀产生,则c(Fe2+)·c(S2-) ≥Ksp=6×10-18 mol2·L-2,即6×10-6mol/L×
x,所以要有FeS沉淀产生,则c(Fe2+)·c(S2-) ≥Ksp=6×10-18 mol2·L-2,即6×10-6mol/L×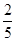 x≥6×10-18 mol2·L-2,解得x≥2.5×10-12 mol/L。
x≥6×10-18 mol2·L-2,解得x≥2.5×10-12 mol/L。
练习册系列答案
相关题目