题目内容
已知:MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O一定质量的二氧化锰溶解在100mL过量的浓盐酸中,当反应生成4.48L氯气(标准状况)时,剩余溶液中盐酸的浓度为1mol/L(假设反应前后体积不变),求:
(1)用双线桥分析该化学方程式电子转移的方向和数目.
(2)反应耗用MnO2的质量?
(3)被氧化的HCl的物质的量?
(4)原浓盐酸的物质的量浓度?
(1)用双线桥分析该化学方程式电子转移的方向和数目.
(2)反应耗用MnO2的质量?
(3)被氧化的HCl的物质的量?
(4)原浓盐酸的物质的量浓度?
(1)化合价降低元素是Mn元素,所在的反应物二氧化锰是氧化剂,Mn元素从+4价变为+2价,得到2个电子;化合价升高元素是Cl元素,所在的反应物HCl是还原剂,双线桥表示为: ,答:
,答: ;
;
(2)4.48L氯气的物质的量为
═0.2mol
设反应耗用MnO2的质量为x,参加反应的HCl物质的量为y
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
8741
x y0.2mol
=
=
解得:x=17.4g y=0.8mol,答:反应耗用MnO2的质量为17.4g;
(3)被氧化的HCl物质的量为
=0.4mol,答:被氧化的HCl物质的量0.4mol;
(4)原浓盐酸的物质的量浓度为
=9mol/L,答:原浓盐酸的物质的量浓度9mol/L.
 ,答:
,答: ;
;(2)4.48L氯气的物质的量为
| 4.48L |
| 22.4L/mol |
设反应耗用MnO2的质量为x,参加反应的HCl物质的量为y
MnO2+4HCl(浓)
| ||
8741
x y0.2mol
| 87 |
| x |
| 4 |
| y |
| 1 |
| 2mol |
解得:x=17.4g y=0.8mol,答:反应耗用MnO2的质量为17.4g;
(3)被氧化的HCl物质的量为
| 0.8mol |
| 2 |
(4)原浓盐酸的物质的量浓度为
| 0.8mol+1mol/L×0.1L |
| 0.1L |

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
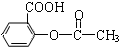 ).为测定某解热镇痛药阿斯
).为测定某解热镇痛药阿斯 冷却后用0.10mol/LHCl溶液返滴过量的NaOH,消耗该HCl溶液25.00mL.
冷却后用0.10mol/LHCl溶液返滴过量的NaOH,消耗该HCl溶液25.00mL.