题目内容
4.TiO2在工业生产和日常生活中有重要用途.(1)工业上用钛矿石(FeTiO3,含FeO、Al2O3、SiO2等杂质)经过下述反应制得:

其中,步骤②发生的反应为:2H2SO4+FeTiO3═TOSO4+FeSO4+2H2O.
①净化钛矿石时,是否需要除去杂质FeO?答:不需要(填“需要”或“不需要”)
②净化钛矿石时,需用浓氢氧化钠溶液来处理.写出该过程中发生反应的化学方程式:Al2O3+2NaOH=2NaAlO2+H2O;SiO2+2NaOH=Na2SiO3+H2O.
(2)TiO2可通过下述两种方法制备金属钛:
方法一是电解TiO2来获得Ti(同时产生O2-);将处理过的TiO2作阴极,石墨为阳极,熔融CaCl2为电解液,用炭块作电解槽池.
(3)阴极反应反应的电极反应式为TiO2+4e-=Ti+2O2-.
(4)电解过程中需定期向电解槽池中加入炭块的原因是碳单质会与阳极产生的氧气反应而不断减少.
方法二是先将TiO2与Cl2、C反应得到TiO4,再用镁还原得到Ti.因下述反应难于发生:TiO2(s)+2Cl2(g)?TiCl1(1)+O2(g)△H=151kJ/mol所以不能直接由TiO2和Cl2反应(即氯化反应)来制取TiO1.当往氯化反应体系中加入碳后,碳与上述反应发生耦合,使得反应在高温条件下能顺利进行.
(5)已知:C(s)+O2(g) CO2(g)△H=-394kJ/mol.请填空:
TiO2(s)+C(s)+2Cl2(g) TiCl4(1)+CO2(g)△H=-243KJ•mol-1
(6)从化学平衡的角度解释:往氯化反应体系中加入碳时,氯化反应能顺利进行的原因是碳单质与氧气反应减小产物浓度,使平衡向右移动,导致反应顺利进行;碳与氧气反应放热,相当于升高温度,平衡向着右移动.
分析 (1)氧化亚铁和硫酸反应生成硫酸亚铁;
(2)二氧化硅是酸性氧化物、氧化铝是两性氧化物都和氢氧化钠溶液反应;
(3)阴极上得电子反应还原反应生成金属钛;
(4)由于电解过程中,电解槽的阳极产生氧气,碳单质会与阳极产生的氧气反应而不断减少;
(5)将方程式TiO2(s)+2Cl2(g)?TiCl4(l)+O2(g)△H=+151kJ•mol-1和C(s)+O2(g)=CO2(g);△H=-394kJ•mol-1相加,得出TiO2与Cl2、C反应制各TiCl4的热化学方程式;
(6)根据外界条件对化学平衡的影响分析,该反应是可逆反应,碳单质与氧气反应减小产物浓度使平衡向右移动,且反应中有热量放出.
解答 解:(1)氧化亚铁和硫酸反应生成硫酸亚铁,所以净化钛矿石时,不需要除去杂质FeO,
故答案为:不需要;
(2)氧化铝是两性氧化物,既能和强酸反应又能和强碱反应生成盐和水Al2O3+2NaOH=2NaAlO2+H2O,
二氧化硅是酸性氧化物,能和强碱反应生成硅酸钠和水SiO2+2NaOH=Na2SiO3+H2O,
故答案为:Al2O3+2NaOH=2NaAlO2+H2O;SiO2+2NaOH=Na2SiO3+H2O;
(3)电解时,阴极上得电子发生还原反应,所以二氧化钛得电子生成钛和氧离子,电极反应式为TiO2+4e-=Ti+2O2-.
故答案为:TiO2+4e-=Ti+2O2-;
(4)由于电解过程中,电解槽的阳极产生氧气,碳单质会与阳极产生的氧气反应而不断减少,所以电解过程中需定期向电解槽池中加入炭块,
故答案为:碳单质会与阳极产生的氧气反应而不断减少;
(5)将方程式TiO2(s)+2Cl2(g)?TiCl4(l)+O2(g)△H=+151kJ•mol-1和C(s)+O2(g)=CO2(g)△H=-394kJ•mol-1相加,
得方程式:TiO2(s)+2Cl2(g)+C(s)=TiCl4(l)+CO2(g)△H=+151kJ•mol-1-394kJ•mol-1=-243KJ•mol-1,
故答案为:-243KJ•mol-1;
(6)TiO2(s)+2Cl2(g)?TiCl4(l)+O2(g),该反应是可逆反应,碳单质与氧气反应减小产物浓度使平衡向右移动,且反应中有热量放出,温度升高,导致反应顺利进行,
故答案为:碳单质与氧气反应减小产物浓度,使平衡向右移动,导致反应顺利进行;碳与氧气反应放热,相当于升高温度,平衡向着右移动.
点评 本题考查了热化学反应方程式、电极反应式的书写等知识点,题目难度中等,充分考查了学生的分析、理解能力,注意热化学反应方程式相加减时,反应热应相应的加减.

 阅读快车系列答案
阅读快车系列答案| A. | 19:8 | B. | 22:1 | C. | 13:8 | D. | 8:13 |
| A. | 只要参加反应的Na2O2的物质的量一定,反应生成的氧气的量就一定 | |
| B. | 只要CO2和H2O(g)的中的物质的量一定,反应所消耗的Na2O2的量就一定 | |
| C. | 只要混合气体的总的物质量一定,反应中所转移的电子的物质的量就一定 | |
| D. | 只要混合气体的总的物质的量一定,固体所增加的质量就一定 |
| A. | 铝 | B. | 硅 | C. | 磷 | D. | 硫 |
| A. | 若a是铁,b是稀硝酸(过量)且a可溶于c溶液中.则a与b反应的离子方程式为Fe+4H++NO3-=Fe3++NO↑+2H2O | |
| B. | 若c,d为气体,且都能使澄清石灰水变浑浊,则将此混合气体通入溴水中,橙色褪去,其褪色过程的离子方程式为SO2+Br2+2H2O=4H++SO42-+2Br- | |
| C. | 若c是无色刺激性气味的气体,其水溶液显弱碱性,在标准状况下用排空气法收集c气体得平均摩尔质量为20 g•mol-1的混合气体进行喷泉实验.假设溶质不扩散,实验完成后所得溶液的物质的量浓度约为0.056 mol•L-1 | |
| D. | 若a是造成温室效应的主要气体之一,c、d均为钠盐,参加反应的a、b物质的量之比为4:5,则上述反应的离子方程式为4CO2+5OH-=CO32-+3HCO3-+H2O |
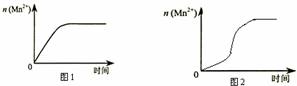 某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:【实验原理】2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.2mol/L KMnO4溶液 | 3 mol/L 稀H2SO4 | ||
| 1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 3.0 | V1 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 4.0 | V2 | ||
(1)补充上表中的实验数据:V1=3.0mL,V2=1.0mL,由表中数据可以得到的结论是 其他条件相同时,增大KMnO4浓度反应速率增大
(2)利用实验 1 中数据计算,用 KMnO4 的浓度变化表示的反应速率为 v(KMnO4)=1.5×10-2mol/(L•min)
(3)该小组同学根据经验绘制了 n(Mn2+)随时间变化趋势的示意图,如图 1 所示.但有同学查阅已有实验资 料发现,该实验过程中 n(Mn2+)随时间变化趋势应如图 2 所示,该小组同学根据图 2 所示信息提出了新的假 设,并继续进行实验探究
①该小组同学提出的假设是生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用)
②请你帮助该小组同学完成实验方案,并填写表中空白.
| 实验 编号 | 室温下,试管中所加试剂及其用量/mL | 在向试管中加 入少量固体 | 室 温 下溶液颜 色 褪 至 无 色 所 需时间/min | |||
| 0.6mol/L H2C2O4 溶液 | H2O | 0.2mol/L KMnO4 溶液 | mol/L 稀 硫酸 | |||
| 4 | 3.0 | 2.0 | 2.0 | t | ||
| A. | Cl2、Br2、I2的沸点逐渐升高,是因为分子间作用力越来越大 | |
| B. | NaOH和NH4Cl化学键类型相同 | |
| C. | N2和CCl4两种分子中,每个原子的最外层都具有8电子稳定结构 | |
| D. | 石英晶体是原子晶体,其分子式为SiO2 |
| A. | 如果设“此”为电解质,“彼”为非电解质,不是所有的物质都是非此即彼的 | |
| B. | 不是所有反应,都遵循由强(如强酸、强碱、强氧化剂或强还原剂等)制弱(如弱酸、弱碱、弱氧化剂 或弱还原剂等)的规律 | |
| C. | 不是所有自发进行的反应都一定是焓减少的过程 | |
| D. | 在迄今发现的元素中,不一定所有非金属元素(稀有气体除外)都满足条件“主族元素的族序数≥其周期序数” |
 2SO3.
2SO3.