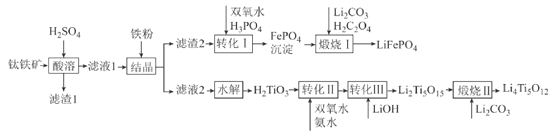
题目内容
【题目】现有常温下甲、乙、丙三种溶液,甲为0.1 mol·L-1的NaOH溶液,乙为0.1 mol·L-1的HCl溶液,丙为0.1 mol·L-1的CH3COOH溶液,试回答下列问题:
(1)甲溶液的pH=________。
(2)丙溶液中存在的电离平衡为______________(用电离平衡方程式表示)。
(3)常温下,用水稀释0.1 mol·L-1的CH3COOH溶液时,下列各量随水量的增加而增大的是________(填序号)。
①n(H+) ②c(H+) ③ c(CH3COOH)/c(CH3COO-) ④c(OH-)
(4)甲、乙、丙三种溶液中由水电离出的c(OH-)的大小关系为___________。
(5)某同学用甲溶液分别滴定20.00 mL乙溶液和20.00 mL丙溶液,得到如图所示的两条滴定曲线,请回答有关问题:
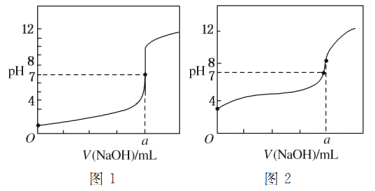
①甲溶液滴定丙溶液的曲线是________(填“图1”或“图2”)曲线。
②a=________。
【答案】13 H2O![]() H++OH-,CH3COOH
H++OH-,CH3COOH![]() CH3COO-+H+ ①④ 丙>甲=乙 图 2 20.00
CH3COO-+H+ ①④ 丙>甲=乙 图 2 20.00
【解析】
(1)0.1molL-1的NaOH溶液中c(OH-)=0.1mol/L,根据Kw=c(H+)c(OH-)计算溶液中c(H+),再根据pH=-lgc(H+)计算溶液的pH值;
(2)溶液中存在水和醋酸,都是弱电解质,存在电离平衡;
(3)用水稀释①0.01molL-1的CH3COOH溶液,醋酸的电离程度增大,溶液中氢离子的物质的量增大,由于体积增大程度较大,所以氢离子浓度减小,据此分析判断;
(4)酸或碱抑制水电离,含有弱根离子的盐促进水电离,据此分析判断;
(5)乙酸为弱电解质,滴定终点时,溶液呈碱性,结合图像分析解答。
(1)0.1molL-1的NaOH溶液中c(OH-)=0.1mol/L,故溶液中c(H+)= ![]() mol/L=10-13mol/L,故该溶液的pH=-lg10-13=13,故答案为:13;
mol/L=10-13mol/L,故该溶液的pH=-lg10-13=13,故答案为:13;
(2)0.1molL-1的CH3COOH溶液中存在溶剂水、水为弱电解质,溶质乙酸为弱电解质,存在电离平衡为CH3COOHCH3COO-+H+,故答案为:H2OOH-+H+、CH3COOHCH3COO-+H+;
(3)①用水稀释0.01molL-1的CH3COOH溶液,醋酸的电离程度增大,溶液中氢离子的物质的量增大,故①正确;②用水稀释0.01molL-1的CH3COOH溶液,醋酸的电离程度增大,溶液中氢离子的物质的量增大,由于体积增大程度较大,所以氢离子浓度减小,故②错误;③加水稀释0.01molL-1的CH3COOH溶液,醋酸的电离平衡常数Ka=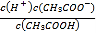 不变,c(H+)减小,所以
不变,c(H+)减小,所以![]() 增大,则
增大,则![]() 减小,故③错误;④用水稀释0.01molL-1的CH3COOH溶液,c(H+)减小,Kw不变,所以c(OH-)增大,故④正确;故答案为:①④;
减小,故③错误;④用水稀释0.01molL-1的CH3COOH溶液,c(H+)减小,Kw不变,所以c(OH-)增大,故④正确;故答案为:①④;
(4)酸或碱抑制水的电离,含有弱根离子的盐促进水的电离,乙酸是弱电解质,氢氧化钠、氯化氢是强电解质,所以相同物质的量浓度的乙酸和盐酸和氢氧化钠,盐酸中水电离出的氢氧根离子浓度小于醋酸,相同物质的量浓度的盐酸和氢氧化钠对水电离抑制程度相等,盐酸中水电离出的氢氧根离子浓度等于氢氧化钠溶液中水电离出的氢氧根离子浓度,所以水电离出的氢氧根离子浓度大小顺序是:丙>甲=乙,故答案为:丙>甲=乙;
(5)①醋酸为弱电解质,滴定过程中pH变化较盐酸缓慢,滴定终点时溶液呈碱性,则滴定醋酸溶液的曲线是图2,故答案为:图2;
②滴定终点时n(CH3COOH)=n(NaOH),则a=20.00mL,反应生成了醋酸钠,醋酸根离子发生水解,CH3COO-+H2OCH3COOH+OH-,溶液显示碱性pH>7,故答案为:20.00。

【题目】某小组利用下面的装置进行实验,②、③中溶液均足量,操作和现象如下表。
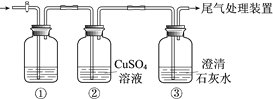
实验 | 操作 | 现象 |
Ⅰ | 向盛有Na2S溶液的①中持续通入CO2至过量 | ②中产生黑色沉淀,溶液的pH降低; ③中产生白色浑浊,该浑浊遇酸冒气泡 |
Ⅱ | 向盛有NaHCO3溶液的①中持续通入H2S气体至过量 | 现象同实验Ⅰ |
资料:CaS遇水完全水解
由上述实验得出的结论不正确的是
A. ③中白色浑浊是CaCO3
B. ②中溶液pH降低的原因是:H2S+Cu2+ == CuS↓+2H+
C. 实验Ⅰ①中CO2过量发生的反应是:CO2+H2O+ S2== CO32+ H2S
D. 由实验Ⅰ和Ⅱ不能比较H2CO3和H2S酸性的强弱