题目内容
【题目】用软锰矿(MnO2)、黄铁矿(FeS2)酸浸生产硫酸锰(MnSO4),并进一步电解制取电解二氧化锰(EMD)的工艺流程如下:
I. 将软锰矿、黄铁矿和硫酸按一定比例放入反应釜中,搅拌,加热保温反应一定时间。
II. 向反应釜中加入MnO2、CaCO3试剂,再加入Na2S溶液除掉浸出液中的重金属。
III. 过滤,向滤液中加入净化剂进一步净化,再过滤,得到精制MnSO4溶液。
IV. 将精制MnSO4溶液送入电解槽,电解制得EMD。
请回答下列问题:
(1)步骤I中搅拌、加热的目的是。完成酸浸过程中反应的离子方程式:
FeS2 + MnO2 + = Mn2+ + Fe2+ + S + SO42-+
(2)加入CaCO3将浸出液pH调至pH=5,从而除掉铁,请解释用CaCO3除铁的原理:。(结合离子方程式解释)
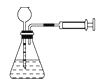
(3)步骤IV中用如图所示的电解装置电解精制的MnSO4溶液,生成EMD的是极(填“a”或“b”),生成EMD的电极反应式是。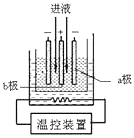
(4)EMD可用作碱性锌锰电池的材料。已知碱性锌锰电池的反应式为:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2。
下列关于碱性锌锰电池的说法正确的是_______(填字母序号)。
A.碱性锌锰电池是二次电池
B.碱性锌锰电池将化学能转化为电能
C.正极反应为:2MnO2+2H2O+2e-=2MnOOH+2OH-
D.碱性锌锰电池工作时,电子由MnO2经外电路流向Zn极
【答案】
(1)加快反应速率,充分接触;1;4;8H+;4;1;4H2O
(2)Fe3++3H2O ![]() Fe(OH)3+3H+
Fe(OH)3+3H+
(3)b;Mn2++2H2O﹣2e﹣=MnO2+4H+
(4)B,C
【解析】(1)将软锰矿、黄铁矿和硫酸按一定比例放入反应釜中,搅拌,加热,加热温度升高,反应速率加快,搅拌可以使反应物充分接触;FeS2反应生成Fe2+、S、SO42- , S元素的化合价升高8价,MnO2中Mn元素的化合价降低2价,则FeS2与MnO2的计量数之比为1:4,结合原子守恒得到方程式为:FeS2+4MnO2+8H+═4Mn2++Fe2++S+SO42-+4H2O;所以答案是:加快反应速率,充分接触;1;4;8H+;4;1;1;4H2O;
(2)在溶液中存在水解平衡:Fe3++3H2O ![]() Fe(OH)3+3H+ , 加入CaCO3后,由于CaCO3(s)
Fe(OH)3+3H+ , 加入CaCO3后,由于CaCO3(s) ![]() Ca2+(aq)+CO32-(aq),CO32-+2H+═CO2↑+H2O,溶液中氢离子浓度减小,使得Fe3+的水解平衡向正反应方向移动,因此Fe3+转化为Fe(OH)3沉淀而被除去;所以答案是: Fe3++3H2O
Ca2+(aq)+CO32-(aq),CO32-+2H+═CO2↑+H2O,溶液中氢离子浓度减小,使得Fe3+的水解平衡向正反应方向移动,因此Fe3+转化为Fe(OH)3沉淀而被除去;所以答案是: Fe3++3H2O ![]() Fe(OH)3+3H+ , 加入CaCO3后,由于CaCO3(s)
Fe(OH)3+3H+ , 加入CaCO3后,由于CaCO3(s) ![]() Ca2+(aq)+CO32-(aq),CO32-+2H+═CO2↑+H2O,使得Fe3+的水解平衡向正反应方向移动,Fe3+转化为Fe(OH)3沉淀而被除去;
Ca2+(aq)+CO32-(aq),CO32-+2H+═CO2↑+H2O,使得Fe3+的水解平衡向正反应方向移动,Fe3+转化为Fe(OH)3沉淀而被除去;
(3)锰离子在阳极失电子生成二氧化锰,b极与正极相连为阳极,所以二氧化锰在b极生成;其电极反应式为:Mn2++2H2O-2e-═MnO2+4H+;所以答案是:b; Mn2++2H2O-2e-═MnO2+4H+;
(4)A.锌锰干电池不能充电,完全放电后不能再使用,属于一次电池,故A错误;B.原电池装置是向外提供电能的装置,其能量转化为化学能转化为电能,故B正确;C.正极上二氧化锰得电子发生还原反应,电极反应式为MnO2+e-+H2O═MnO(OH)+OH- , 故C正确;D.电子从负极沿导线流向正极,而电流从正极沿着导线流向负极,则电子由Zn极经外电路流向MnO2 , 故D错误.所以答案是:BC。

【题目】下列实验方案、现象和结论均正确的是( )
选项 | 实验方案 | 现象 | 结论 |
A |
| 向里推活塞时,长颈漏斗中有一段水柱,静止,水柱高度不变 | 该装置的气密性良好 |
B |
| 脱脂棉燃烧 | Na2O2与水反应生成氢氧化钠和氧气 |
C |
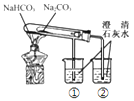
| 烧杯①的澄清石灰水先变浑浊 | NaHCO3比Na2CO3受热更易分解 |
D |
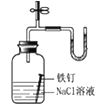
| U形管右端的液面高 | 铁钉发生吸氧腐蚀 |
A.A
B.B
C.C
D.D