题目内容
【题目】氢化钠![]() 化合物中钠元素是
化合物中钠元素是![]() 价,NaH跟水反应放出
价,NaH跟水反应放出![]() ,下列叙述正确的是( )
,下列叙述正确的是( )
A.在NaH中的氢离子半径比锂离子半径大
B.在NaH中的氢离子的电子层排布与![]() 不相同
不相同
C.NaH跟水反应后溶液呈酸性
D.NaH中的氢离子被还原成氢气
【答案】A
【解析】
A.H-离子和Li+离子电子层结构相同,锂离子核电荷数大于H-,核电荷数越大,离子半径越小,故H-离子半径大于Li+离子半径,故A正确;
B.NaH中H元素是-1价,其核外电子数为2,所以其电子层排布与Li+的相同,故B错误;
C.NaH中H元素是-1价,氢化钠和水放出氢气,氢气单质中H元素的化合价为0价,氢元素的化合价升高到0,氢气单质中有两个氢原子,一个是升高的,另一个氢原子降低,根据元素守恒写出化学方程式:![]() ,有NaOH生成,其水溶液显碱性,故C错误;
,有NaOH生成,其水溶液显碱性,故C错误;
D.反应![]() 中,NaH中H元素是-1价,生成物氢气中H元素的化合价为0价,氢元素的化合价升高,氢化钠中氢离子被氧化成氢气,故D错误;
中,NaH中H元素是-1价,生成物氢气中H元素的化合价为0价,氢元素的化合价升高,氢化钠中氢离子被氧化成氢气,故D错误;
答案选A。

【题目】氮元素的单质及其化合物在工农业生产、生活中有着重要作用。
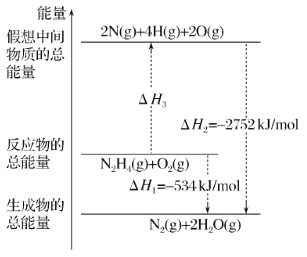
(1)已知:反应i:N2(g)+3H2(g)2NH3(g) △H=-92.4kJ/mol
反应ii:2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol
则氨气完全燃烧生成氮气和水蒸气的热化学方程式_____。
(2)已知反应i断开1mol化学键所需的能量见下表:
N≡N | H—H | N—H | |
键能/kJ·mol-1 | 945 | 436 | ? |
则断开1molN-H键所需的能量是_______kJ
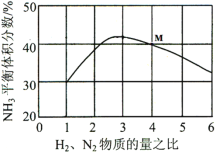
(3)如图表示反应i在500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中M点数据计算N2的平衡体积分数______;该反应的化学平衡常数K的表达式______。
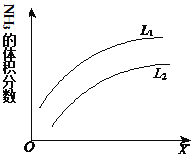
(4)如图是合成氨反应平衡混合气中NH3的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强。其中X代表的是______(填“温度”或“压强”);判断L1、L2的大小关系并说明理由_______。
(5)电化学气敏传感器可用于检测环境中NH3的含量,其工作原理如图所示:
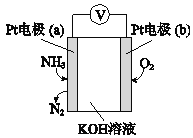
①反应消耗NH3和O2的物质的量之比为____。
②a极的电极反应式为______。
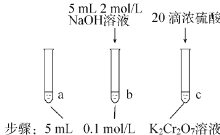
【题目】某同学研究浓度对化学平衡的影响,下列说法正确的是
| 待试管b中颜色不变后与试管a比较,溶液颜色变浅。滴加浓硫酸,试管c温度略有升高,溶液颜色与试管 a 相比,变深。 |
已知:![]() (aq)(橙色) + H2O(l)2
(aq)(橙色) + H2O(l)2![]() (aq) (黄色)+ 2H+(aq) △H=+13.8 kJ/mol
(aq) (黄色)+ 2H+(aq) △H=+13.8 kJ/mol
A.该反应为氧化还原反应
B.待试管 b 中溶液颜色不变的目的是使![]() 完全反应
完全反应
C.试管c中的现象说明影响平衡的主要因素是温度
D.该实验不能证明减小生成物浓度平衡正向移动
【题目】一定温度下,在4个容积均为1 L的恒容容器中分别进行反应(各容器中A都足量)A(s)+B(g)![]() C(g)+D(g) ΔH =+100 kJ·mol-1,某时刻测得部分数据如下表:
C(g)+D(g) ΔH =+100 kJ·mol-1,某时刻测得部分数据如下表:
容器编号 | n(B)/mol | n(C)/mol | n(D)/mol | 反应时间/min | 反应速率 |
Ⅰ | 0.06 | 0.60 | 0.10 | t1 | v(正)=v(逆) |
Ⅱ | 0.12 | 1.20 | 0.20 | t2 | |
Ⅲ | 0.32 | 1.0 | 0 | 0 | |
Ⅳ | 0.12 | 0.30 | v(正)=v(逆) |
下列说法正确的是
A.容器Ⅰ中平均反应速率v(B)=0.04/t1 mol·L-1·min-1
B.t2时容器Ⅱ中v(正)>v(逆)
C.容器Ⅲ
D.容器Ⅳ中c(D)= 0.4 mol·L-1
【题目】已知反应![]() ,在某温度下的平衡常数为400。此温度下,在密闭容器中加入
,在某温度下的平衡常数为400。此温度下,在密闭容器中加入![]() ,反应进行到某时刻测得各组分的浓度如下:
,反应进行到某时刻测得各组分的浓度如下:
物质 |
|
|
|
浓度 |
|
|
|
下列叙述中正确的是![]()
A.该反应的平衡常数表达式为 ![]()
B.该时刻正、逆反应速率的大小:![]()
C.平衡时![]()
D.若加入![]() 后,经
后,经![]() 反应达到平衡,该时间内反应速率
反应达到平衡,该时间内反应速率![]()
【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
实验装置 | 部分实验现象 |
| a极质量减小,b极质量增加 |
| b极有气体产生,c极无变化 |
| d极溶解,c极有气体产生 |
| 电流计指示在导线中电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>dB.b>c>d>aC.d>a>b>cD.a>b>d>c