题目内容
一定温度下,反应2SO2(g)+O2(g)  2SO3(g),达到平衡时,n(SO2)∶n(O2)∶n(SO3)=2∶3∶4。缩小体积,反应再次达到平衡时,n(O2)=0.8 mol,n(SO3)=1.4 mol,此时SO2的物质的量应是( )。
2SO3(g),达到平衡时,n(SO2)∶n(O2)∶n(SO3)=2∶3∶4。缩小体积,反应再次达到平衡时,n(O2)=0.8 mol,n(SO3)=1.4 mol,此时SO2的物质的量应是( )。
| A.0.4 mol | B.0.6 mol | C.0.8 mol | D.1.2 mol |
A
解析

练习册系列答案
 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目
下列图示与对应的叙述相符的是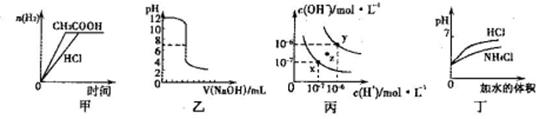
| A.甲图曲线表示向等体积、等物质的量浓度的盐酸和醋酸溶液中分别加人足量镁粉产生H2的物质的量的变化 |
| B.乙表示将0.01mol·L-lNaOH溶液滴人到稀盐酸中的滴定曲线 |
| C.丙为水的电离曲线,从z点刭x点,可采用在水中加入适量NaOH固体的方法 |
| D.丁中曲线表示将pH相同的NH4C1溶液和盐酸稀释相同倍数时,二者pH的变化 |
某温度下,密闭容器中X、Y、Z、W四种气体的初始浓度和平衡浓度如下表,下列说法错误的是
| 物质 | X | Y | Z | W |
| 初始浓度/mol·L-1 | 0.5 | 0.6 | 0 | 0 |
| 平衡浓度/mol·L-1 | 0.1 | 0.1 | 0.4 | 0.6 |
A.反应达到平衡时,X的转化率为80%
B.该反应的平衡常数表达式为K=
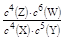
C.增大压强其平衡常数不变,但使平衡向生成Z的方向移动
D.改变温度可以改变此反应的平衡常数
对于可逆反应N2(g)+3H2(g)  2NH3(g);ΔH<0,下列研究目的和示意图相符的是 ( )。
2NH3(g);ΔH<0,下列研究目的和示意图相符的是 ( )。
| | A | B | ||
| 研究 目的 | 压强对反应的影 响(p2>p1) | 温度对反应的影响 | ||
| 图示 | 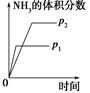 | 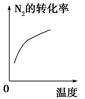 | ||
| | C | D | | |
| 研究 目的 | 平衡体系增加N2 对反应的影响 | 催化剂对反应的影响 | | |
| 图示 | 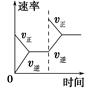 |  | | |
化学平衡常数(K)、电离常数(Ka)、溶度积常数(Ksp)是判断物质性质或变化的重要的常数。下列关于这些常数的说法中,正确的是( )
| A.化学平衡常数的大小与温度、浓度、压强、催化剂有关 |
| B.CH3COONH4溶液几乎呈中性,说明Ka(CH3COOH)与Kb(NH3·H2O)近似相等 |
| C.Ksp(AgCl)>Ksp(AgI),由此可以判断AgCl(s)+I-=AgI(s)+Cl-能够发生 |
| D.Ka(HCN)<Ka(CH3COOH),说明相同浓度时,氢氰酸的酸性比醋酸强 |
煤本身是可燃物质,但是块状的煤用明火靠近都不燃烧,而当煤变为粉末状态时,在空气中达到一定的浓度遇明火即迅速爆炸,其原因是( )。
| A.粉末状态的煤比块状煤的着火点低 |
| B.粉末状态的煤比块状煤放出的热量多 |
| C.粉末状态的煤比块状煤的总表面积大 |
| D.粉末状态的煤呈气态,属于可燃性气体 |
一定条件下,可逆反应2A(g) B(g)+3C(g),下列四项中处于平衡状态的是( )
B(g)+3C(g),下列四项中处于平衡状态的是( )
| | 正反应速率 | 逆反应速率 |
| A | v(A)=2mol/(L·min) | v(B)=2mol/(L·min) |
| B | v(A)=2mol/(L·min) | v(C)=2mol/(L·min) |
| C | v(A)=1mol/(L·min) | v(B)=2mol/(L·min) |
| D | v(A)=1mol/(L·min) | v(C)=1.5mol/(L·min) |
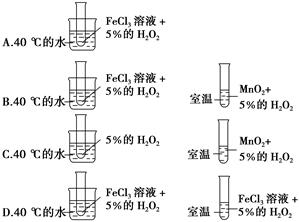
 2C(g)达到平衡状态标志的是( )。
2C(g)达到平衡状态标志的是( )。