题目内容
【题目】25℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH 的关系如下图所示。下列有关叙述正确的是
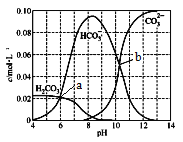
A. b点所示的溶液中:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(Cl-)
B. 随pH增大,![]() 数值先减小后增大
数值先减小后增大
C. 25℃时,碳酸的第一步电离常数Ka1=10-6
D. 溶液呈中性时:c(HCO3- )>c(Cl-)>c(CO32-)
【答案】C
【解析】A、由图解可知,b点时pH>10,且c(CO32-)=c(HCO3-),即少量的盐酸与碳酸钠反应,则溶液的溶质为NaCl、Na2CO3与Na HCO3,根据电荷守恒可得:c(Na+)+c(H+)=2c(CO32-)+ c(HCO3-)+c(OH-)+c(Cl-),或者c(Na+)+c(H+)=3c(CO32-)+c(OH-)+c(Cl-),所以A错误;B、由图象知,从pH>8开始,c(CO32-)逐渐增大,c(HCO3-)逐渐减小,所以![]() 数值增大,故B错误;C、由a点可知,当pH=6时,即c(H+)=10-6mol/L,c(H2CO3)= c(HCO3-)=0.02mol/L,碳酸的第一步电离方程式为H2CO3
数值增大,故B错误;C、由a点可知,当pH=6时,即c(H+)=10-6mol/L,c(H2CO3)= c(HCO3-)=0.02mol/L,碳酸的第一步电离方程式为H2CO3![]() H++HCO3-,则Ka1=
H++HCO3-,则Ka1=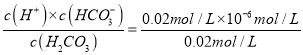 =10-6mol/L,故C正确;D、当溶液呈中性时,发生的反应为①Na2CO3+HCl=NaCl+NaHCO3和②NaHCO3+HCl=NaCl+CO2↑+H2O,在反应①中,生成的NaCl和NaHCO3浓度相等,在反应②中,生成的NaHCO3又消耗一部分,所以c(NaCl)>c(NaHCO3),即c(Cl—)>c(HCO3—),所以D错误。本题正确答案为C。
=10-6mol/L,故C正确;D、当溶液呈中性时,发生的反应为①Na2CO3+HCl=NaCl+NaHCO3和②NaHCO3+HCl=NaCl+CO2↑+H2O,在反应①中,生成的NaCl和NaHCO3浓度相等,在反应②中,生成的NaHCO3又消耗一部分,所以c(NaCl)>c(NaHCO3),即c(Cl—)>c(HCO3—),所以D错误。本题正确答案为C。

 53随堂测系列答案
53随堂测系列答案【题目】有机物A可用于制备常见的解热镇痛药阿司匹林.纯净的A为白色结晶性粉末,易溶于水.为研究A的组成与结构,进行了如下实验:
实验步骤 | 解释或实验结论 |
(1)称取A 6.9g,升温使其汽化,测其密度是相同条件下CH4的8.625倍. | (1)A的相对分子质量为: . |
(2)将此6.9g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重2.7g和15.4g | (2)A的分子式为: . |
(3)另取A 6.9g,跟足量的NaHCO3粉末反应,生成1.12L CO2(标准状况),若与足量金属钠反应则生成1.12L H2(标准状况). | (3)用结构简式表示A中含有的官能团: |
(4)A的核磁共振氢谱显示A有6种氢 | A的结构简式 |
(5)写出A与浓溴水反应的方程式: | |
【题目】下表所列各组物质中,物质之间通过一步反应不能实现如图所示转化的是()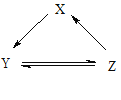
项目 | X | Y | Z |
A | Si | SiO2 | H2SiO3 |
B | Na | NaOH | NaCl |
C | NO | NO2 | HNO3 |
D | NaClO | HClO | Cl2 |
A. A B. B C. C D. D